NOUVEAUTES DANS LE TRAITEMENT DES HYPOPARATHYROIDIES
Les MUST de l’Endocrinologie – IPSEN – 22e édition
Illias HAMNY1, Philippe CHANSON2, Françoise BORSON-CHAZOT1
1 Fédération d’Endocrinologie, Groupement Hospitalier Est, Hospices Civils de Lyon, Lyon, France ; Université Claude Bernard Lyon 1, Lyon, France
2 Université Paris-Saclay, Inserm, Physiologie et Physiopathologie Endocriniennes, Assistance Publique-Hôpitaux de Paris, Hôpital Bicêtre, Service d’Endocrinologie et des Maladies de la Reproduction, Le Kremlin-Bicêtre, France
Auteur correspondant : Illias Hamny, Fédération d’endocrinologie et maladies métaboliques, Hospices Civils de Lyon, hôpital cardiovasculaire Louis-Pradel, 28, avenue Doyen-Lépine, 69677 Bron, France illias.hamny@chu-lyon.fr
RESUME
Le traitement de l’hypoparathyroïdie chronique demeure un défi thérapeutique. Cette pathologie endocrinienne survient dans trois-quart des cas dans les suites d’une chirurgie cervicale mais peut aussi s’intégrer dans d’autres cadres nosologiques, notamment génétiques, plus rares. Le traitement conventionnel repose sur l’administration de calcium et de vitamine D active per os. Une proportion importante de patients reste cependant non contrôlée biologiquement avec une persistance de manifestations cliniques altérant la qualité de vie. L’utilisation plus récente de la parathormone s’est heurtée à la demi-vie courte de l’hormone nécessitant des injections pluriquotidiennes ou une administration sous cutanée continue par pompe. Depuis peu, les progrès dans la connaissance de la physiopathologie de l’hypoparathyroïdie ouvrent la voie à de nouvelles approches thérapeutiques par des formes de parathormone (PTH) à durée d’action prolongée, des analogues du récepteur de la PTH ou, plus récemment, des calcilytiques. Ces molécules font actuellement l’objet d’essais thérapeutiques dont les résultats sont encourageants. Cependant, leur impact à long terme sur le métabolisme osseux et la fonction rénale restent à définir, conditionnant leur utilisation future.
1- Introduction
L’hypoparathyroïdie est une pathologie endocrinienne rare avec une prévalence estimée à 37 cas pour 100 000 habitants aux Etats-Unis. En Europe, on estime que 110 000 patients en sont porteurs [1].
Cette affection est caractérisée par l’association d’une hypocalcémie, d’une hyperphosphatémie, d’une concentration de parathormone (PTH) basse ou inadaptée et d’une hypercalciurie [2]. Elle est due dans l’immense majorité des cas à un défaut de sécrétion de PTH ; exceptionnellement à une résistance à la PTH.
La cause la plus fréquente (75% des cas) est l’hypoparathyroïdie post-opératoire chez les adultes ayant eu une chirurgie cervicale (chirurgie de la thyroïde ou des parathyroïdes) [3]. Dans ce cas, l’hypoparathyroïdie transitoire concernerait, selon les séries, 7 à 46% des patients [4] et l’hypoparathyroïdie ne deviendrait chronique que pour 0,9 à 1,6% des chirurgies [5].
Les autres causes sont représentées par l’hypoparathyroïdie auto-immune. Celle-ci peut être isolée ou s’intégrer dans une pathologie syndromique telle que la polyendocrinopathie auto-immune de type 1 (PEAI 1) [6]. On retrouve le plus souvent des anticorps anti-parathyroïde et dans une moindre mesure des anticorps anti-récepteur du calcium (CaSR) chez les jeunes patients [7]. On identifie aussi des causes génétiques qui peuvent être isolées (PTH, GCMB, CASR, SOX3…) ou s’intégrer dans des syndromes (syndrome de Di George) ou des pathologies mitochondriales. Enfin, l’hypoparathyroïdie peut être acquise (en dehors de l’étiologie post-opératoire) : hypomagnésémie, thalassémie ou hémochromatose [8-9]. Les différentes étiologies d’hypoparathyroïdie sont résumées dans le tableau 1.
Les résistances à la PTH sont exceptionnelles (prévalence de 0.34 à 1.1 cas pour 100 000 habitants), observées dans les pseudohypoparathyroidies. Le tableau biologique se distingue de celui des hypoparathyroïdies communes par des concentrations de PTH élevées. [10].
La parathormone est une hormone peptidique de 84 acides aminés dont la partie N-terminale biologiquement active se lie au récepteur de la PTH. Il s’agit d’une hormone hypercalcémiante qui régule l’homéostasie phosphocalcique. La sécrétion physiologique de PTH est pulsatile et obéit à un rythme circadien avec un nadir en fin de matinée et en fin d’après-midi [11]. Sa sécrétion est régulée via un récepteur ubiquitaire couplé à une protéine G, le CASR. La PTH agit via son récepteur le PTH1R (récepteur à 7 domaines transmembranaires) sur le remodelage osseux, l’absorption digestive de calcium via la production rénale de 1-alpha hydroxylase et la réabsorption tubulaire rénale de calcium expliquant ainsi le tableau biologique. La voie de signalisation est celle de l’AMPc/PKA. (Fig.1)
Les manifestations cliniques de l’hypoparathyroïdie sont le principal motif d’altération de la qualité de vie chez les patients. Elles se caractérisent par des paresthésies des extrémités et péribuccales (dans 75% des cas), une augmentation du tonus musculaire avec crampes et raideur. L’hypocalcémie sévère peut parfois s’associer à des spasmes bronchiques et/ou laryngés [12]. Un retentissement cognitif s’observe chez un tiers des patients. Il se manifeste principalement par une altération des fonctions supérieures, une asthénie chronique et une labilité thymique [13]. Les crises comitiales se voient dans 4 à 8% des cas ; on note également une altération des fonctions motrices (syndrome extrapyramidal, bradykinésie) chez 4 à 12% des patients [14]. Ces manifestations sont liées à la calcification des noyaux gris centraux.
Les noyaux gris centraux ne sont pas le seul siège de calcifications ; on retrouve également des calcifications des tissus mous par précipitation de calcium et de phosphore. Ces produits phosphocalciques se rencontrent dans tout type de tissu et peuvent être à l’origine de déformations ou de douleurs articulaires chroniques. Les manifestations ophtalmologiques sont observées dans 50% des cas et sont représentées par la cataracte, le plus souvent postérieure ; les manifestations dentaires sont décrites dans 20 à 80% des cas : il s’agit principalement d’un déficit de l’émail dentaire.
L’hypocalcémie peut avoir un retentissement cardiaque, se traduisant principalement par des troubles du rythme dus à un allongement du QTc. Des cas de dysfonction du ventricule gauche ont également été rapportés dans la littérature [15].
Les retentissements rénal et osseux sont, cependant, les principales problématiques posées par l’hypoparathyroïdie. En effet, l’hypercalciurie présente chez près de la moitié des patients expose à un sur-risque de lithiases rénales, d’altération de la fonction rénale et de néphrocalcinose. La minéralisation osseuse est également altérée avec une augmentation de l’ostéorésorption et une diminution de l’ostéoformation. Cependant, les études réalisées n’ont pas montré de sur-risque significatif de fractures des patients avec hypoparathyroïdie comparé aux populations témoins [16-17].
2- Principes généraux de la prise en charge des patients hypoparathyroïdiens
L’hypoparathyroïdie est une des seules pathologies endocriniennes où l’hormone manquante n’est pas couramment substituée. Les principaux objectifs du traitement chez les hypoparathyroïdiens sont l’obtention d’un contrôle biochimique (avec normalisation de la calcémie et de la phosphorémie), la limitation de l’hypercalciurie et donc des complications rénales. Les autres objectifs sont osseux – avec la stimulation du remodelage osseux et la reminéralisation osseuse – et l’amélioration de la qualité de vie des patients.
La prise en charge actuelle des hypoparathyroïdiens consiste en l’administration de calcium élément par voie orale (2-3 fois par jour à raison de 1 à 5 g par jour) et d’analogues de la vitamine D active. Ces traitements présentent des limites notamment en termes de tolérance digestive des sels de calcium et d’hypercalciurie associée à la prise de calcitriol que l’on retrouve dans 50% des cas [17]. L’administration de diurétiques thiazidiques est proposée pour réduire l’hypercalciurie mais son efficacité est insuffisante dans un tiers des cas.
L’hypercalciurie induit un sur-risque de complications rénales, rapporté, notamment, par une étude de cohorte rétrospective menée pendant 10 ans (2007-2017) et comparant près de 8100 hypoparathyroïdiens traités à 40 000 témoins. En cas d’hypoparathyroïdie sous traitement, le risque de développer des lithiases rénales est multiplié par 3, et celui de développer une insuffisance rénale chronique et/ou une néphrocalcinose par 4-5 [18-19].
Enfin, une cohorte française (Epi-hypo) rassemblant près de 1500 hypoparathyroïdiens a montré que près de 45% d’entre eux, présentent une persistance de symptômes à type de crampes et paresthésies malgré un traitement bien mené et un contrôle biochimique obtenu. Cela est probablement lié aux variations de concentration de calcium au cours du nycthémère. Par ailleurs, l’équilibre phosphocalcique ne serait pas obtenu chez ¼ des patients (données non publiées).
Ces différentes limitations du traitement conventionnel ont mené à l’idée de remplacer directement, l’hormone manquante, la PTH.
3- Qu’en est-il de la substitution de l’hormone manquante ?
3.1 PTH (1-34
L’alternative récente est une substitution en parathormone (PTH). Le traitement disponible en France est l’administration d’un analogue de la PTH : la PTH 1-34 ou teriparatide (constitué des 34 premiers acides aminés). Ce traitement n’a cependant pas l’autorisation de mise sur le marché (AMM) dans le traitement des hypocalcémies mais l’a dans le traitement de l’ostéoporose. Sa demi-vie est courte (environ 1 heure) [20]. Le traitement est administré en injections quotidiennes (en 1 ou 2 injections). Winer et al, dans une étude de 2003 comparant le traitement par PTH vs calcitriol, n’ont pas trouvé d’amélioration significative de la calcémie ni de la calciurie des 24 heures [21]. Cependant, un effet significatif sur la masse osseuse a pu être observé avec une augmentation des marqueurs de l’ostéoformation ce qui fait son intérêt dans le traitement de l’ostéoporose. La PTH est plus efficace lorsqu’elle est délivrée en continu sous forme de pompe sous-cutanée sur le modèle de l’insuline. Cette modalité thérapeutique présente comme avantage de normaliser plus rapidement le bilan phosphocalcique et même la calciurie [22]. Les effets sur l’os sont les mêmes que ceux observés avec les injections.
Au total la PTH 1-34 est un traitement bien toléré mais qui n’apporte pas de bénéfice supplémentaire sur le bilan phosphocalcique en dehors d’une administration en continu.
3.2 PTH (1-84)
Il s’agit d’un analogue de synthèse de la PTH native. Maanstadt et al ont évalué la PTH (1-84) en injections sous-cutanées quotidiennes vs placebo en association au traitement conventionnel au cours d’un essai de 3 ans incluant 124 hypoparathyroïdiens dans l’étude REPLACE [23]. L’efficacité (contrôle de la calcémie et diminution d’au moins 50% des traitements par sels de calcium et calcitriol) et la tolérance du traitement ont été évaluées. Après 24 semaines, 54% des patients recevant la PTH (1-84) remplissaient le critère de jugement principal contre 2.5% dans le groupe placebo (différence de plus de 52.5 % entre les 2 groupes ; IC 95 ⦋40.6-64⦌, p< 0.01). Dans le groupe ayant reçu la PTH (1-84), 69% des patients ont baissé leurs besoins en calcitriol de plus de 50% (contre 7.5% dans le groupe placebo ; IC95 ⦋58 ; 78.7⦌, p<001). Pour ce qui est des besoins en calcium, 86.9% présentent une baisse supérieure à 50% de leurs besoins (contre 45% dans le groupe placebo ; IC95 ⦋77.8-93.3⦌, p< 001). Cependant, les analyses post-hoc ne montraient pas de différence significative sur le contrôle de la calcémie entre le groupe traité par PTH 1-84 et le groupe placebo. (différence absolue de 0.6% ⦋-11.8-13.0⦌) [23].
Le bénéfice sur l’os a été évalué par l’étude RACE en 2019, étude prospective randomisée, impliquant 49 patients traités pendant 5 ans et comparant PTH (1-84) vs placebo. Une amélioration significative de la densité minérale osseuse lombaire et fémorale a été observée mais avec une dégradation sur le tiers distal du radius qui n’est pas expliquée [24].
Le service médical rendu de la PTH (1-84) a été considéré comme insuffisant pour obtenir l’AMM en France mais le traitement est commercialisé aux Etats-Unis.
3.3 Efficacité comparée des PTH (1-34) et PTH (1-84)
Puliani et al ont regroupé les principales études prospectives évaluant les traitements par PTH (1-34) et PTH (1-84). Trente-six études ont été analysées. Globalement, le traitement par PTH n’améliore pas le contrôle biochimique et notamment la calcémie par rapport au traitement conventionnel (sels de calcium et calcitriol). Cependant, sous PTH, on observe moins de variations de la calcémie au cours des 24 heures qu’avec le traitement conventionnel. En revanche, la substitution en PTH est supérieure au traitement conventionnel pour ce qui concerne le contrôle de la calciurie des 24 heures et les marqueurs du remodelage osseux. Aucune différence significative n’a été notée entre la PTH (1-34) et la PTH (1-84) tant sur le contrôle biochimique que sur l’abaissement de la calciurie ou encore la densité minérale osseuse et la qualité de vie des patients [25].
Cette méta-analyse présente comme principales limitations de porter majoritairement sur des études non randomisées (26/36) avec de petits effectifs en sachant que les 10 études contrôlées randomisées comparaient principalement la PTH (1-84) au placebo. Par ailleurs, les paramètres étudiés n’étaient pas uniformes d’une étude à l’autre et une faible proportion d’entre elles ont cherché à évaluer la qualité de vie ou l’effet sur la masse osseuse.
Les résultats de la substitution en parathormone ne sont donc pas aussi probants qu’attendus notamment sur le contrôle biochimique et sur le sevrage en traitement per os. C’est dans ce contexte que de nouvelles perspectives thérapeutiques ont été développées afin d’obtenir un contrôle phosphocalcique optimal tout en limitant au maximum les complications rénales et osseuses.
4. Perspectives thérapeutiques
4.1 TransCon PTH (1-34)
Il s’agit d’une prodrogue à longue durée d’action (sa demi-vie est de 60 heures) initialement sous forme inactive et associée à un transporteur (carrier) et à une molécule de liaison (linker). En conditions physiologiques de pH et de température, un auto-clivage du linker a lieu entraînant la libération de la PTH qui devient active et se fixe à son récepteur. (Fig.2)
La fixation de la molécule au récepteur PTHR1 induit une activation prolongée de la voie de signalisation AMPc/PKA ce qui permet de maintenir les effets du traitement sur une durée d’au moins 24 heures [26].
Ce traitement s’administre sous forme d’injections sous-cutanées et reproduit le profil pharmacocinétique d’une administration continue de PTH par pompe sous-cutanée et ce pendant plusieurs jours. Cela permet de s’affranchir des pics et des nadirs de concentration en PTH observés avec les multi-injections.
L’essai de phase 2 PaTH Forward avait pour but d’évaluer cette nouvelle molécule en double-insu, vs placebo puis en ouvert pendant une durée totale de 214 semaines. Il s’agit d’une étude multicentrique incluant 59 patients présentant des hypoparathyroïdies d’étiologies variées (excluant les patients avec hypocalcémie autosomique dominante) traités par sels de calcium et calcitriol. Les 59 patients ont été randomisés en 4 sous-groupes (15, 18 et 21µg ou placebo).
Ils ont reçu une dose fixe de traitement pendant les 4 premières semaines. En fonction du contrôle biochimique et du besoin de poursuivre ou non le traitement par sels de calcium et calcitriol, la dose de TransCon PTH a été augmentée, diminuée ou inchangée pendant la phase ouverte. Un critère de jugement composite comprenant la normalisation de la calcémie, le sevrage en calcitriol, la baisse – en dessous de 1 g par jour – des besoins en sels de calcium et la baisse d’au moins 50% de la calciurie sur échantillon a été évalué à la 4ème, 26ème et 58ème semaine. D’autres éléments, tels que la phosphatémie, les produits phosphocalciques, la calciurie des 24 heures, la qualité de vie et le remodelage osseux ont été évalués pendant la phase de titration en ouvert [27].
A la 4ème semaine, 50% (22/44) des patients traités par TransCon PTH (1-34) remplissaient les critères de jugement composite contre 15% (2/13) dans le groupe placebo (p < 0.03). Près de 82% (36/44) des patients traités ont pu être sevrés en calcitriol et ont pu baisser leurs apports en sels de calcium contre seulement 15% (2/13) dans le groupe placebo (2/13)
Les résultats se confirment à la 26ème et à la 58ème semaine sur le contrôle biochimique et sur la calciurie des 24 heures (415 mg/24h à J0 vs 178 mg/24h à S26) ainsi que sur la qualité de vie (échelle SF-36 et HPES). (Fig.3A, 3B et 3C)
Le profil de tolérance est bon et il n’y a pas eu d’effets indésirables graves. Les principaux effets secondaires sont les céphalées (17% des patients), des nausées (8.5% des patients) et l’hypertension artérielle (7% des patients). Trois patients ont eu un épisode d’hypocalcémie modérée. Il n’y a pas eu d’épisode d’hypercalcémie grave [27].
4.2 Analogues du couple PTH/récepteur PTH (PTH/PTHR) : AZP-3601 (LA-PTH)
Une nouvelle molécule, l’AZP-3601, développée il y a quelques années cible le couple PTH/PTHR. Il s’agit d’un peptide agissant sélectivement sur une conformation allostérique précise du récepteur de la PTH. En effet, le récepteur de la PTH existe sous 2 conformations allostériques principales : R0 et RG. Le récepteur est sous la conformation R0 lorsqu’il est lié à la molécule au niveau du tubule rénal. Ceci permet une endocytose de l’AZP-3601 et une activation prolongée de la voie de signalisation AMPc/PKA par cycles multiples et donc une réabsorption tubulaire durable de calcium. Au niveau de l’os, le récepteur est sous sa conformation RG en présence de la molécule. L’effet est donc moins prolongé [28].
Le traitement est administré en injections sous-cutanées quotidiennes. Sa demi-vie est courte (quelques heures) mais la répétition des cycles au niveau rénal permet d’obtenir un effet prolongé. Le traitement a été testé chez l’animal et les résultats ont été publiés en 2016. La molécule a notamment été administrée à des singes parathyroïdectomisés et on observe un effet dose-dépendant avec, parfois des hypercalcémies majeures aux doses de médicament les plus élevées. Le traitement a été comparé à la PTH (1-34) et à la PTH (1-84). On observe une élévation de la calcémie plus importante avec l’AZP-3601 qu’avec les traitements par PTH. L’effet sur la calcémie est également plus durable (environ 48 à 36 heures) que les traitements par PTH (durée d’action de l’ordre de 6 à 7 heures) [29].
Une étude de phase 2, est en cours pour évaluer l’AZP-3601 chez l’homme. Cette étude multicentrique porte sur 12 patients avec hypoparathyroïdie dont la moyenne d’âge est de 62 ans. Le traitement a été initié à la dose de 20 µg/jour et augmenté jusqu’à 40 µg/jour. Les 8 semaines suivantes, la dose de traitement a été ajustée en fonction des besoins en calcitriol et en sels de calcium (doses entre 10 et 60 µg/jour). Les éléments évalués sont la calcémie, la phosphatémie, la calciurie des 24 heures, le turn-over osseux (dosage du P1NP et des C-télopeptides ou CTx) ainsi que la qualité de vie.
Les résultats préliminaires ont été présentés au Congrès Européen d’Endocrinologie de 2022. Dès le 14ème jour, les besoins en sels de calcium et en calcitriol ont diminué de manière significative. La majorité des patients a pu être sevrée en calcitriol. On note une baisse significative de la calciurie des 24 heures dès le J14 avec des résultats qui se maintiennent dans le temps. Les effets sur le remodelage osseux sont tout aussi probant tant sur l’ostéoformation que sur la résorption osseuse. En effet, on note une augmentation du P1NP et des CTx dès J14 avec un effet qui se maintient au cours des 3 mois de l’étude. Les effets sur la densité minérale osseuse ne sont pas encore disponibles. Le traitement est bien toléré. A ce jour, aucun effet indésirable n’a été déclaré. (Fig.4).
4.3 Les calcilytiques (encaleret)
L’hypocalcémie autosomique dominante (ou ADH1) est une pathologie rare d’origine génétique en rapport avec une mutation activatrice du gène CASR. Cette pathologie a une prévalence de 1 cas pour 70 000 habitants [30]. C’est la pathologie en miroir de l’hypercalcémie hypocalciurique familiale qui se caractérise par une hypocalcémie et une hypercalciurie. En effet, le CASR est plus sensible, son seuil de réponse (set-point) est diminué entraînant une freination de la sécrétion de PTH qui conduit à une excrétion urinaire accrue de calcium. Les complications rénales sont au premier plan chez ces patients dont l’hypercalciurie obéit à 2 mécanismes : l’hypoparathyroïdie et la suractivité du CASR.
L’enjeu, chez cette population, est de corriger le set-point du CASR afin de limiter les complications rénales en lien avec l’hypercalciurie. Pour cela, une nouvelle classe thérapeutique a été développée ; les calcilytiques. Ces derniers sont administrés par voie orale et agissent comme des modulateurs allostériques négatifs à l’image des calcimimétiques utilisés dans l’hyperparathyroïdie primitive. Le set-point du CASR est ainsi décalé vers la droite.
Des études de phase 2 sont en cours sur de petits effectifs de patients présentant une ADH1. Il s’agit de 6 patients âgés de 20 à 60 ans et ayant reçu le traitement quotidien. Les premiers résultats après 5 jours de traitement ont été présentés au Congrès Européen d’Endocrinologie de 2022. L’encaleret est administré par voie orale en 1 à 2 prises par jour. Les 3 premiers jours, les patients reçoivent une dose progressivement croissante (entre 30 et 180 mg). Les 2 derniers jours, les patients reçoivent 180 mg par jour de traitement. Les paramètres étudiés sont le contrôle de la calcémie, la phosphatémie, la concentration de PTH et la calciurie des 24 heures.
Les résultats sont probants sur l’ensemble des paramètres avec une normalisation de la calcémie au bout de 5 jours. Les concentrations de PTH sont en moyenne multipliés par 60 au 5ème jour avec une calciurie des 24 heures divisée par 4. Les résultats sur l’os restent à définir car les modifications sur le remodelage osseux sont plus lentes à apparaitre.
Les calcilytiques semblent efficaces sur le contrôle biochimique plasmatique et la calciurie dans cette pathologie. Mais ils pourraient constituer une alternative thérapeutique dans d’autres causes d’hypoparathyroïdie.
Conclusion
Le traitement de l’hypoparathyroïdie demeure un défi thérapeutique malgré un traitement conventionnel vitaminocalcique est efficace et reste le traitement de référence.
Cependant, chez certains patients, le contrôle clinique et biologique n’est pas obtenu et l’hypercalciurie et les complications rénales qui en découlent demeurent une problématique importante.
De nouvelles thérapeutiques dont été développées dans cette optique afin d’obtenir à la fois un contrôle clinico-biologique, une diminution des complications rénales et également un effet bénéfique sur l’os.
La TransCon PTH (1-34), l’AZP-3601 et les calcilytiques montrent des résultats prometteurs sur l’ensemble de ces aspects et pourraient être de bonnes alternatives thérapeutiques. Cependant, aucune de ces thérapeutiques n’est commercialisée et le recul pour évaluer les effets sur l’os, le rein et la tolérance est insuffisant. D’autres études avec des suivis prolongés seront nécessaires pour évaluer pleinement l’efficacité et la sécurité
| Etiologies des hypoparathyroïdies |
| Post-chirurgicale (la plus fréquente ; 75% des cas)
Auto-immune ou APECED syndrome (3 à 5%) Hypomagnésémie Antécédent d’irradiation cervicale Causes génétiques ; Hypoparathyroïdie Autosomique Dominante de type 1 (ADH1) ; syndrome de Di George Pathologies mitochondriales, hyperparathyroïdie primitive maternelle Idiopathique (15% des cas) |
Tableau 1 : étiologies des hypoparathyroïdies
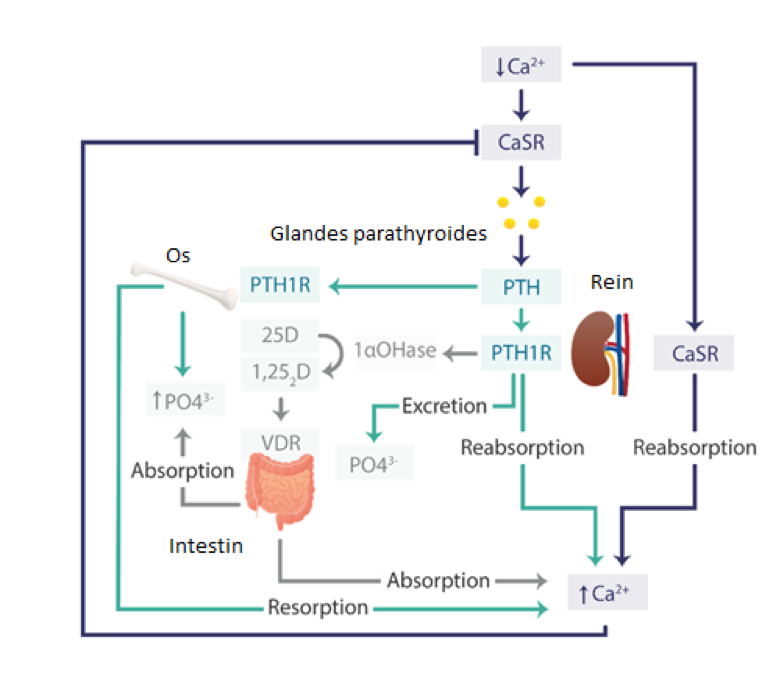
Figure 1 : Schéma de la régulation de l’homéostasie phospho-calcique, adapté d’après Roszko et al., JMBR, 2022
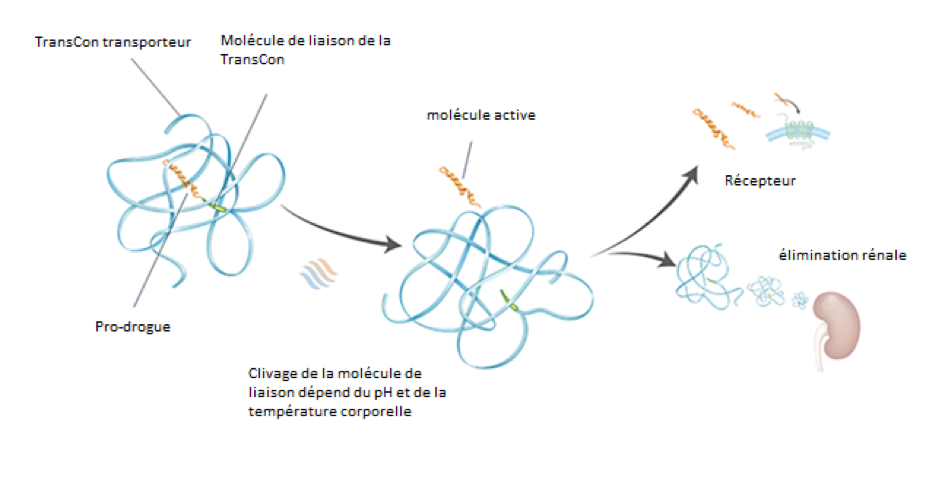
Figure 2 : Schéma du fonctionnement de la TransCon PTH (1-34) adapté d’après Khan et al, JCEM, 2022
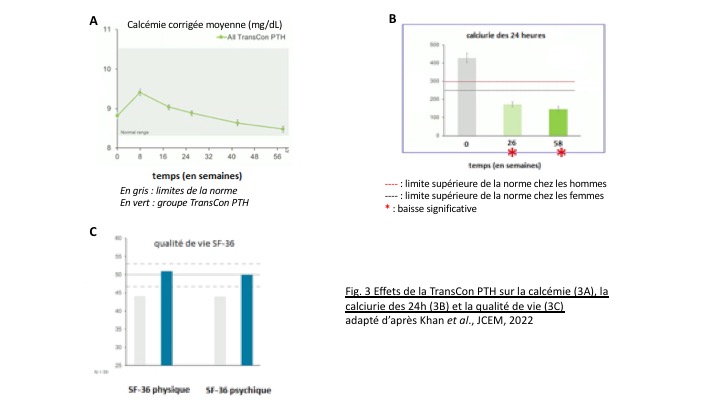
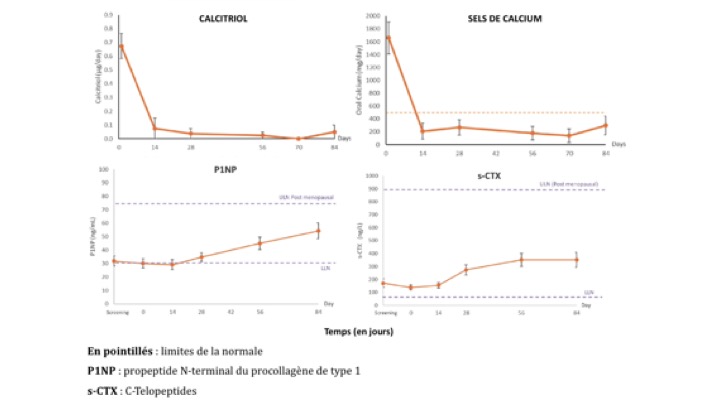
Figure 4 : Effets de l’AZP-3601 sur les besoins en calcitriol (4A), en sels de calcium (4B) et sur les marqueurs du remodelage osseux (4C). Les résultats sont présentés en moyennes adapté de Efficacy and Safety of AZP-3601, a Novel Investigational Long-Acting PTH Analog for Treatment of Hypoparathyroidism. Results From the First Cohort of a 3-Month Multi-Center Open Label Phase 2a Study
Cet article a bénéficié du soutien institutionnel d’Ipsen Pharma, le 1er auteur ayant été un participant des Must de l’Endocrinologie 2022.
1. Mannstadt M, Bilezikian JP, Thakker RV, Hannan FM, Clarke BL, Rejnmark L, et al. Hypoparathyroidism. Nat Rev Dis Primer. 31 août 2017;3:17055.
2. Bilezikian JP. Hypoparathyroidism. J Clin Endocrinol Metab. 1 juin 2020;105(6):dgaa113.
3. Marx SJ. Hyperparathyroid and hypoparathyroid disorders. N Engl J Med. 21 déc 2000;343(25):1863‑75.
4. Falk SA, Birken EA, Baran DT. Temporary postthyroidectomy hypocalcemia. Arch Otolaryngol Head Neck Surg. févr 1988;114(2):168‑74.
5. Thomusch O, Machens A, Sekulla C, Ukkat J, Brauckhoff M, Dralle H. The impact of surgical technique on postoperative hypoparathyroidism in bilateral thyroid surgery: a multivariate analysis of 5846 consecutive patients. Surgery. févr 2003;133(2):180‑5.
6. Eisenbarth GS, Gottlieb PA. Autoimmune polyendocrine syndromes. N Engl J Med. 13 mai 2004;350(20):2068‑79.
7. Brown EM. Anti-parathyroid and anti-calcium sensing receptor antibodies in autoimmune hypoparathyroidism. Endocrinol Metab Clin North Am. juin 2009;38(2):437‑45, x.
8. Milman S, Epstein EJ. Proton pump inhibitor-induced hypocalcemic seizure in a patient with hypoparathyroidism. Endocr Pract Off J Am Coll Endocrinol Am Assoc Clin Endocrinol. févr 2011;17(1):104‑7.
9. Toumba M, Sergis A, Kanaris C, Skordis N. Endocrine complications in patients with Thalassaemia Major. Pediatr Endocrinol Rev PER. déc 2007;5(2):642‑8.
10. Underbjerg L, Sikjaer T, Mosekilde L, Rejnmark L. Pseudohypoparathyroidism – epidemiology, mortality and risk of complications. Clin Endocrinol (Oxf). juin 2016;84(6):904‑11.
11. Schmitt CP, Schaefer F, Bruch A, Veldhuis JD, Schmidt-Gayk H, Stein G, et al. Control of pulsatile and tonic parathyroid hormone secretion by ionized calcium. J Clin Endocrinol Metab. déc 1996;81(12):4236‑43.
12. Bilezikian JP, Khan A, Potts JT, Brandi ML, Clarke BL, Shoback D, et al. Hypoparathyroidism in the adult: epidemiology, diagnosis, pathophysiology, target-organ involvement, treatment, and challenges for future research. J Bone Miner Res Off J Am Soc Bone Miner Res. oct 2011;26(10):2317‑37.
13. Arlt W, Fremerey C, Callies F, Reincke M, Schneider P, Timmermann W, et al. Well-being, mood and calcium homeostasis in patients with hypoparathyroidism receiving standard treatment with calcium and vitamin D. Eur J Endocrinol. févr 2002;146(2):215‑22.
14. Aggarwal S, Kailash S, Sagar R, Tripathi M, Sreenivas V, Sharma R, et al. Neuropsychological dysfunction in idiopathic hypoparathyroidism and its relationship with intracranial calcification and serum total calcium. Eur J Endocrinol. juin 2013;168(6):895‑903.
15. Vered I, Vered Z, Perez JE, Jaffe AS, Whyte MP. Normal left ventricular performance documented by Doppler echocardiography in patients with long-standing hypocalcemia. Am J Med. avr 1989;86(4):413‑6.
16. Underbjerg L, Sikjaer T, Mosekilde L, Rejnmark L. The Epidemiology of Nonsurgical Hypoparathyroidism in Denmark: A Nationwide Case Finding Study. J Bone Miner Res Off J Am Soc Bone Miner Res. sept 2015;30(9):1738‑44.
17. Underbjerg L, Sikjaer T, Mosekilde L, Rejnmark L. Cardiovascular and renal complications to postsurgical hypoparathyroidism: a Danish nationwide controlled historic follow-up study. J Bone Miner Res Off J Am Soc Bone Miner Res. nov 2013;28(11):2277‑85.
18. Ketteler M, Chen K, Gosmanova EO, Signorovitch J, Mu F, Young JA, et al. Risk of Nephrolithiasis and Nephrocalcinosis in Patients with Chronic Hypoparathyroidism: A Retrospective Cohort Study. Adv Ther. avr 2021;38(4):1946‑57.
19. Gosmanova EO, Houillier P, Rejnmark L, Marelli C, Bilezikian JP. Renal complications in patients with chronic hypoparathyroidism on conventional therapy: a systematic literature review : Renal disease in chronic hypoparathyroidism. Rev Endocr Metab Disord. juin 2021;22(2):297‑316.
20. Tay D, Cremers S, Bilezikian JP. Optimal dosing and delivery of parathyroid hormone and its analogues for osteoporosis and hypoparathyroidism – translating the pharmacology. Br J Clin Pharmacol. févr 2018;84(2):252‑67.
21. Kk W, Cw K, Jc R, K D, M K, D P, et al. Long-term treatment of hypoparathyroidism: a randomized controlled study comparing parathyroid hormone-(1-34) versus calcitriol and calcium. J Clin Endocrinol Metab [Internet]. sept 2003 [cité 23 sept 2022];88(9). Disponible sur: https://pubmed.ncbi.nlm.nih.gov/12970289/
22. Winer KK. Advances in the treatment of hypoparathyroidism with PTH 1-34. Bone. mars 2019;120:535‑41.
23. Mannstadt M, Clarke BL, Vokes T, Brandi ML, Ranganath L, Fraser WD, et al. Efficacy and safety of recombinant human parathyroid hormone (1-84) in hypoparathyroidism (REPLACE): a double-blind, placebo-controlled, randomised, phase 3 study. Lancet Diabetes Endocrinol. déc 2013;1(4):275‑83.
24. Tay YKD, Tabacco G, Cusano NE, Williams J, Omeragic B, Majeed R, et al. Therapy of Hypoparathyroidism With rhPTH(1-84): A Prospective, 8-Year Investigation of Efficacy and Safety. J Clin Endocrinol Metab. 1 nov 2019;104(11):5601‑10.
25. Puliani G, Hasenmajer V, Simonelli I, Sada V, Pofi R, Minnetti M, et al. Safety and Efficacy of PTH 1-34 and 1-84 Therapy in Chronic Hypoparathyroidism: A Meta-Analysis of Prospective Trials. J Bone Miner Res Off J Am Soc Bone Miner Res. juill 2022;37(7):1233‑50.
26. A Randomized Double-Blind Placebo-Controlled First-In-Human Phase 1 Trial of TransCon PTH in Healthy Adults – PubMed [Internet]. [cité 19 juill 2022]. Disponible sur: https://pubmed.ncbi.nlm.nih.gov/32212275/
27. Khan AA, Rejnmark L, Rubin M, Schwarz P, Vokes T, Clarke B, et al. PaTH Forward: A Randomized, Double-Blind, Placebo-Controlled Phase 2 Trial of TransCon PTH in Adult Hypoparathyroidism. J Clin Endocrinol Metab. 1 janv 2022;107(1):e372‑85.
28. Cheloha RW, Gellman SH, Vilardaga JP, Gardella TJ. PTH receptor-1 signalling-mechanistic insights and therapeutic prospects. Nat Rev Endocrinol. déc 2015;11(12):712‑24.
29. Shimizu M, Joyashiki E, Noda H, Watanabe T, Okazaki M, Nagayasu M, et al. Pharmacodynamic Actions of a Long-Acting PTH Analog (LA-PTH) in Thyroparathyroidectomized (TPTX) Rats and Normal Monkeys. J Bone Miner Res Off J Am Soc Bone Miner Res. juill 2016;31(7):1405‑12.
30. Gunn IR, Gaffney D. Clinical and laboratory features of calcium-sensing receptor disorders: a systematic review. Ann Clin Biochem. nov 2004;41(Pt 6):441‑58.
