Item 42 – Aménorrhée
________________________________________________________________________
Situations de départ
- 24 Bouffées de chaleur.
- 25 Hypersudation.
- 26 Anomalies de la croissance staturo-pondérale.
- 33 Difficulté à procréer.
- 40 Écoulement mamelonnaire.
- 63 Troubles sexuels et troubles de l’érection.
- 78 Acné.
- 79 Hirsutisme.
- 80 Alopécie et chute des cheveux.
- 94 Troubles du cycle menstruel.
- 113 Puberté précoce ou retardée.
- 164 Anomalie de l’examen clinique mammaire.
________________________________________________________________________________
________________________________________________________________________________
Hiérarchisation des connaissances
________________________________________________________________________________
| Rang | Rubrique | Intitulé | Descriptif |
| A | Définition | Savoir définir une aménorrhée et une spanioménorrhée | Aménorrhée primaire ou secondaire, spanioménorrhée |
| B | Éléments physiopathologiques | Connaître la régulation de l’axe hypothalamo-hypophyso-ovarien | |
| A | Diagnostic positif | Démarche diagnostique devant une aménorrhée primaire ou secondaire | |
| B | Étiologie | Connaître les deux principaux diagnostics en cas d’absence d’utérus à l’échographie | |
| B | Étiologie | Connaître les deux principales causes d’aménorrhée secondaire d’origine utérine | |
| B | Étiologie | Connaître les principales causes d’insuffisance ovarienne | Anomalies du caryotype, prémutation FRM1, auto-immunes, iatrogènes |
| B | Étiologie | Connaître les principales causes d’insuffisance gonadotrope | |
| B | Étiologie | Connaître les principales causes d’aménorrhée avec hyperandrogénie | |
| B | Étiologie | Savoir diagnostiquer une aménorrhée hypothalamique fonctionnelle et en connaître les principales étiologies | |
| B | Étiologie | Connaître les principales étiologies des hyperprolactinémies | |
________________________________________________________________________________
Aménorrhée
- Introduction
- Conduite diagnostique
- Etiologie des aménorrhées
I Introduction
L’aménorrhée est un motif fréquent de consultation.
Elle est arbitrairement définie par l’absence de cycle menstruel chez la fille après l’âge de 16 ans avec ou sans développement pubertaire (aménorrhée primaire) ou par son interruption chez une femme préalablement réglée (aménorrhée secondaire).
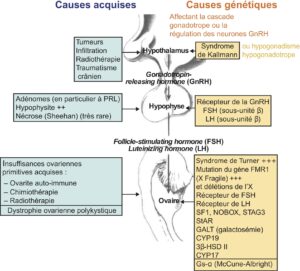
La distinction classique entre aménorrhées primaire et secondaire est artificielle puisque leurs causes sont en partie communes. Elle souligne simplement que les premières relèvent surtout de causes chromosomiques et génétiques, les secondes de causes acquises (fig. 1).
________________________________________________________________________________
Fig. 1
Représentation schématique de l’axe hypothalamo-hypophyso-ovarien.
Les principales causes des aménorrhées affectant cet axe sont indiquées. À droite : causes génétiques. À gauche : lésions acquises.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
L’absence de règles est physiologique pendant la grossesse, la lactation et la ménopause.
En dehors de ces périodes, l’existence de cycles menstruels réguliers témoigne du bon fonctionnement global de l’axe gonadotrope, des ovaires et de l’intégrité utérine. Toute interruption du cycle menstruel au-delà d’un mois, même après arrêt d’une contraception orale, est anormale et justifie une enquête étiologique.
Un traitement œstroprogestatif sans exploration préalable est donc toujours illégitime (+++).
C’est après la recherche d’une cause que sera proposé un traitement étiologique ou, à défaut, une substitution de l’insuffisance hormonale.
L’aménorrhée peut être précédée d’irrégularités menstruelles (oligo/spanioménorrhée) dont la valeur sémiologique est similaire et l’enquête étiologique identique.
L’exploration d’une aménorrhée conduit nécessairement à la découverte de pathologies qui sont détaillées ailleurs. Seuls les principaux aspects diagnostiques sont évoqués ici.
II Conduite diagnostique
A Aménorrhée primaire
1 Interrogatoire
Devant une aménorrhée primaire, la probabilité d’une cause génétique ou chromosomique est importante (cf.fig. 1). Il convient donc de rechercher l’existence, dans la famille, d’autres individus atteints de retard pubertaire ou d’aménorrhée, d’hypogonadisme ou d’infertilité.
L’interrogatoire permet aussi de rechercher une carence nutritionnelle liée ou non à une maladie chronique (+++).
2 Examen clinique général et gynécologique, explorations de première ligne
Développement pubertaire
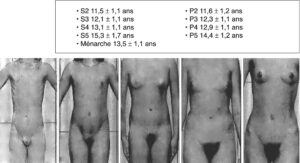
Il précisera le développement pubertaire complètement absent ou quasi « normal » avec un développement mammaire qui est fonction de la sécrétion ovarienne d’œstradiol. Ce développement s’apprécie selon les stades de Tanner (tableaux 1 et 2, fig. 2).
________________________________________________________________________________
Tableau 1
Développement mammaire (S) selon Tanner. (Source : CEEDMM, 2021.)
| S1 | Absence de développement mammaire |
| S2 | Petit bourgeon mammaire avec élargissement de l’aréole |
| S3 | La glande mammaire dépasse la surface de l’aréole |
| S4 | Développement maximal du sein (apparition d’un sillon sous-mammaire)
Saillie de l’aréole et du mamelon sur la glande |
| S5 | Aspect adulte
Disparition de la saillie de l’aréole |
________________________________________________________________________________
________________________________________________________________________________
Tableau 2
Pilosité pubienne (P) selon Tanner. (Source : CEEDMM, 2021.)
| P1 | Absence de pilosité |
| P2 | Quelques poils longs sur le pubis |
| P3 | Pilosité pubienne au-dessus de la symphyse |
| P4 | Pilosité pubienne fournie |
| P5 | La pilosité s’étend à la racine de la cuisse et s’allonge vers l’ombilic chez le garçon |
________________________________________________________________________________
________________________________________________________________________________
Fig. 2
Développement des caractères sexuels chez la fille.
S, seins ; P, pilosité pubienne.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
L’exploration hormonale de première intention comprend le dosage de l’œstradiol, de la FSH et de la LH. En cas de gonadotrophines basses, après avoir éliminé une tumeur hypothalamo-hypophysaire et une dénutrition, on recherchera une anosmie et d’autres signes évoquant le syndrome de Kallmann (encadré).
En cas de gonadotrophines hautes, la petite taille et le syndrome malformatif (inconstant) feront évoquer un syndrome de Turner dont le diagnostic sera confirmé par la réalisation d’un caryotype (formule 45,X ou mosaïque 45,X/46,XX).
________________________________________________________________________________
Encadré – Causes génétiques d’hypogonadismes hypogonadotrophiques
Les hypogonadismes hypogonadotrophiques congénitaux et le syndrome de Kallmann sont une cause d’aménorrhée primaire avec gonadotrophines basses. Ces maladies se révèlent dans moins de 30 % des cas par une absence complète de développement pubertaire ; en revanche, l’aménorrhée primaire est quasi constante.
S’il s’agit d’un syndrome de Kallmann, s’associe à l’hypogonadisme hypogonadotrophique une absence ou une diminution de la perception des odeurs (anosmie/hyposmie). Dans les syndromes de Kallmann, l’hypogonadisme résulte d’une anomalie de la migration des neurones à GnRH de la placode olfactive vers le noyau arqué pendant la vie embryonnaire, qui ne sont pas en position anatomique permettant une stimulation des gonadotrophines hypophysaires LH et FSH (anomalie de migration due notamment à la mutation du gène KAL1 codant l’anosmine). À l’IRM, les bulbes olfactifs sont absents ou hypoplasiques.
L’existence d’un hypogonadisme hypogonadotrophique congénital ou d’un syndrome de Kallmann chez une femme consultant pour aménorrhée primaire impose une enquête et un conseil génétique rigoureux car les formes autosomiques dominantes pouvant être transmises à la descendance sont fréquentes.
Plusieurs autres mutations ont été décrites, que ce soit sur le récepteur de la GnRH, de la FSH, de la LH ou d’autres acteurs impliqués dans la régulation hypothalamo-hypophysaire de l’axe gonadotrope. Selon la mutation, le développement pubertaire sera plus ou moins complet, et donc pourront exister des formes d’oligo-/spanioménorrhée.
Sur le plan hormonal, en fonction de l’atteinte gonadotrope, l’œstradiol et les gonadotrophines peuvent être effondrés ou atteindre des valeurs proches de celles d’une phase folliculaire.
________________________________________________________________________________
Examen gynécologique
Il a pour but de visualiser le degré de pilosité. Dans certains cas, il peut évaluer la perméabilité et la trophicité du vagin et du col.
Il sera complété par une échographie pelvienne de bonne qualité ou une IRM pelvienne qui précisera la présence, la taille et la position des gonades et l’existence ou non d’un utérus (avec la taille et l’aspect pré- ou post-pubère).
L’absence d’utérus, souvent associée à un vagin borgne, orientera vers un syndrome de Rokitanski ou un trouble de l’hormonosynthèse ou de la réceptivité aux androgènes (syndrome d’insensibilité aux androgènes). Dans ce dernier cas, le caryotype révèle une formule 46,XY.
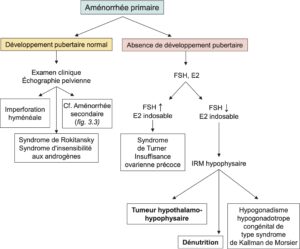
Devant une aménorrhée primaire chez une adolescente ayant par ailleurs un développement pubertaire et chez qui l’échographie retrouve un utérus, il peut s’agir d’un hématocolpos, soit une accumulation des règles en intra-utérin en lien avec une imperforation de l’hymen. En dehors de ce diagnostic, la démarche diagnostique, après avoir vérifié l’absence de grossesse et d’une agénésie utérine, sera similaire à celle d’une aménorrhée secondaire (fig. 3).
________________________________________________________________________________
Fig. 3
Arbre décisionnel devant une aménorrhée primaire.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
B Aménorrhée secondaire
Les aménorrhées secondaires sont le plus souvent le résultat d’une pathologie acquise après la puberté (cf.fig. 1).
Cependant, une anomalie génétique est toujours possible, surtout si l’aménorrhée a été précédée d’irrégularités menstruelles depuis la puberté, parfois malencontreusement masquées par un traitement œstroprogestatif administré « pour régulariser les règles ».
________________________________________________________________________________
La mise en route d’un traitement œstroprogestatif, sans enquête étiologique préalable, chez une adolescente ou une femme consultant pour aménorrhée est une erreur car elle amène à méconnaître des diagnostics parfois graves (+++).
________________________________________________________________________________
1 Interrogatoire
L’interrogatoire recherchera :
- des causes évidentes comme une grossesse (adolescentes +++) ;
- certaines prises médicamenteuses (antidopaminergiques élevant la prolactine, comme par exemple des antinauséeux, des neuroleptiques ; macroprogestatifs, entraînant une aménorrhée par atrophie de l’endomètre), une corticothérapie ou des traitements inhibant la commande hypothalamo-hypophysaire (chirurgie de la région hypothalamo-hypophysaire, radiothérapie), des traitements gonadotoxiques (radiothérapie, chimiothérapie +++, chirurgie ovarienne) ;
- une maladie endocrinienne ou chronique (par exemple, maladie cœliaque) pouvant retentir sur l’axe gonadotrope, le fonctionnement ovarien ou l’état nutritionnel ;
- l’histoire gynécologique et obstétricale, qui sera utile pour dater l’ancienneté de l’aménorrhée ;
- des bouffées de chaleur, inconstantes, qui feront suspecter une insuffisance ovarienne ;
- des douleurs pelviennes cycliques orientant vers une cause utérine, d’autant plus qu’il existe une notion de geste endo-utérin (curetage, IVG).
2 Examen clinique
Devant toute aménorrhée, la mesure du poids et de la taille avec l’établissement de l’indice de masse corporelle (Poids/Taille2) est nécessaire pour dépister une carence nutritionnelle relative (+++). Elle sera complétée par une enquête nutritionnelle, évaluant la quantité de lipides ingérés et le degré d’activité physique, surtout si l’IMC est inférieur à 21 kg/m2.
Les signes d’hyperandrogénie (séborrhée, acné, hirsutisme) peuvent accompagner une aménorrhée. Ils orientent vers certaines causes, en particulier le syndrome des ovaires polykystiques ou un déficit en 21-hydroxylase et, plus rarement, un syndrome de Cushing (cf. infra).
Une galactorrhée doit être recherchée mais, en pratique, ce signe clinique est d’une sensibilité et d’une spécificité insuffisantes : même en son absence un dosage de prolactine sera réalisé.
L’examen gynécologique, lorsqu’il est réalisable, est important pour apprécier l’état des muqueuses et visualiser le col et la glaire.
Les signes de carence œstrogénique sont présents lorsque l’atteinte gonadotrope ou ovarienne est profonde. L’aménorrhée s’accompagne alors d’une sécheresse de la muqueuse vaginale, possiblement responsable d’une dyspareunie.
Le test aux progestatifs est classique mais n’a pas beaucoup d’intérêt dans la démarche étiologique ; il a pour but d’apprécier la sécrétion ovarienne d’œstradiol d’une femme en aménorrhée. Il consiste en l’administration d’un progestatif pendant 10 jours. Ce test, qui rend compte de l’imprégnation par les œstrogènes de l’endomètre, est dit positif si surviennent des règles dans les 5 jours suivant l’arrêt du progestatif. Il est au contraire négatif lorsque la carence œstrogénique est sévère, et cela indépendamment de sa cause. Le test aux progestatifs est négatif en cas de carence œstrogénique profonde et ancienne ou de grossesse.
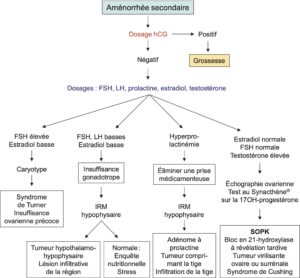
3 Dosages hormonaux de première intention (+++)
Les premiers examens complémentaires auront pour but :
- d’écarter une grossesse méconnue : hCG ;
- puis de rechercher les causes les plus fréquentes (Fig. 4), par dosages de prolactine, œstradiol (E2), FSH, LH ± testostérone totale :
- hyperprolactinémie :
- prolactinémie élevée ;
- E2 bas ;
- LH basse ;
- FSH basse ou « normale » ;
- hyperprolactinémie :
-
- syndrome des ovaires polymicrokystiques (SOPK) :
- E2 comme dans un début de phase folliculaire : par exemple, E2 entre 30 et 70 pg/ml (valeurs seulement indicatives) ;
- LH normale ou augmentée ;
- FSH un peu basse ou normale ;
- testostérone totale normale ou un peu augmentée ;
- déficit gonadotrope :
- E2 bas ;
- concentrations de LH et de FSH basses ou non élevées (c’est-à-dire « dans les normes » mais non cycliques, inadaptées) ;
- syndrome des ovaires polymicrokystiques (SOPK) :
-
- insuffisance ovarienne :
- E2 bas ;
- concentrations élevées de LH et surtout de FSH (FSH >> LH).
- insuffisance ovarienne :
Ces pathologies reconnaissables par leur profil hormonal représentent la grande majorité des causes d’aménorrhée secondaire (cf.fig. 4) (+++).
________________________________________________________________________________
Fig. 4
Arbre décisionnel devant une aménorrhée secondaire.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
II Étiologie des aménorrhées
A Aménorrhées avec carence œstrogénique secondaire à un déficit gonadotrope d’origine organique ou fonctionnelle
(Œstradiol bas, gonadotrophines « normales » ou basses.)
Synonymes : hypogonadisme hypogonadotrophique, dénommé aussi hypogonadisme central.
1 Aménorrhée d’origine hypothalamique avec prolactine normale
La cause la plus fréquente d’aménorrhée hypothalamique est l’aménorrhée hypothalamique fonctionnelle secondaire à une restriction calorique associée ou non à une activité physique intense (+++) : incapacité de l’hypothalamus à libérer la GnRH avec une pulsatilité de fréquence et d’amplitude compatibles avec la physiologie de la reproduction. Bien que très souvent classées comme psychogènes, elles semblent très souvent en rapport avec un apport calorique insuffisant et/ou une activité physique excessive et associées à des perturbations des paramètres reflétant l’état nutritionnel et des troubles du comportement alimentaire (cf. Item 71).
Dans les cas extrêmes, des pertes de poids importantes (moins de 66 % du poids idéal ou IMC < 16 kg/m2) sont associées à un déficit gonadotrope profond. C’est le cas de l’anorexie mentale.
Le tableau le plus fréquent d’aménorrhée hypothalamique fonctionnelle, plus difficile à diagnostiquer, est observé chez des femmes jeunes apparemment de poids normal consultant pour un arrêt des règles mais dont les apports nutritionnels, en particulier en lipides, sont insuffisants par rapport à leur dépense énergétique. Ces patientes ont une diminution significative de leur masse grasse qui participe probablement à la genèse du déficit gonadotrope fonctionnel.
Une IRM de la région hypothalamo-hypophysaire est utile pour écarter une éventuelle tumeur ou infiltration. Le diagnostic d’aménorrhée hypothalamique fonctionnelle doit être établi après avoir éliminé une cause organique.
2 Atteintes organiques de l’hypothalamus
Elles dominent les préoccupations diagnostiques et une IRM doit être réalisée devant toute aménorrhée hypothalamique, même en l’absence de stigmates cliniques ou biologiques d’atteinte des autres fonctions antéhypophysaires ou posthypophysaires.
La radiothérapie encéphalique ou de la base du crâne entraîne également une atteinte hypothalamique.
Les tumeurs en cause sont essentiellement les craniopharyngiomes (+++). Les processus infiltratifs les plus fréquentes sont la sarcoïdose, les infundibulo-hypophysites et l’histiocytose.
3 Aménorrhée hypothalamo-hypophysaire secondaire à une hyperprolactinémie (+++)
Cette cause est également traitée dans le chapitre consacré aux adénomes hypophysaires (cf. Item 244 – Adénome hypophysaire).
Sur le plan diagnostique, il faut simplement insister sur le fait qu’elles sont responsables de près de 20 % des aménorrhées par déficit gonadotrope, il s’agit donc d’une cause majeure d’aménorrhée, qu’elle soit accompagnée de galactorrhée ou non.
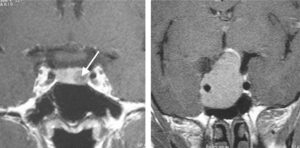
En l’absence de prise de médicaments hyperprolactinémiants, les hyperprolactinémies résultent le plus souvent de l’existence de tumeurs, comme des adénomes à prolactine surtout (fig. 5) et des tumeurs de la région hypothalamo-hypophysaire comme des macroadénomes hypophysaires, des craniopharyngiomes ou des méningiomes qui peuvent induire une hyperprolactinémie de déconnexion.
________________________________________________________________________________
Fig. 5
Microadénome et macroadénome à prolactine révélés par une aménorrhée secondaire.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Sur le plan symptomatique, l’hyperprolactinémie peut débuter par des irrégularités menstruelles puis se compléter par une aménorrhée qui traduit alors simplement une atteinte gonadotrope plus profonde.
Bien que les causes d’hyperprolactinémies se situent fréquemment à l’étage hypophysaire, l’effet antigonadotrope de la prolactine s’exerce de façon prédominante, sinon exclusive, au niveau hypothalamique par diminution de la sécrétion hypothalamique de GnRH.
4 Aménorrhées par déficits gonadotropes d’origine hypophysaire
Ces déficits d’origine hypophysaire sont beaucoup plus rares que les atteintes hypothalamiques.
Sur le plan étiologique, le très rare syndrome de Sheehan résulte classiquement d’une nécrose hypophysaire du post-partum à la suite d’un accouchement hémorragique avec collapsus vasculaire. Le tableau clinique associe une aménorrhée du post-partum et une absence de montée laiteuse. Les déficits gonadotrope et lactotrope en sont la cause chez ces patientes qui présentent, en majorité, une insuffisance antéhypophysaire globale.
En fait, une grande majorité des aménorrhées par déficit gonadotrope du post-partum est due à une atteinte auto-immune de l’hypophyse. Ces hypophysites lymphocytaires (++) peuvent, comme la nécrose hypophysaire, se révéler par une absence de montée laiteuse et une aménorrhée du post-partum, mais il manque la notion étiologique d’accouchement hémorragique.
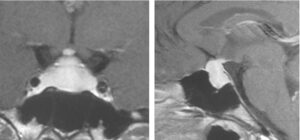
L’IRM hypophysaire permet de suspecter le diagnostic en montrant une grosse hypophyse en hypersignal spontané, parfois d’allure pseudotumorale (fig. 6), ou, inversement, une selle turcique vide. De même, l’existence d’une insuffisance antéhypophysaire dissociée est en faveur de ce diagnostic.
________________________________________________________________________________
Fig. 6
Aspect en IRM d’une hypophysite lymphocytaire révélée par une aménorrhée du post-partum.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
B Insuffisances ovariennes primitives
Les insuffisances ovariennes primitives regroupent différentes affections ovariennes ayant comme dénominateur commun une atteinte de la folliculogenèse. La signature biologique constante est l’élévation de la FSH, ce qui correspond donc à un hypogonadisme hypergonadotrope. Si l’épuisement du capital folliculaire se complète avant l’âge de la puberté, la présentation clinique sera celle d’une absence complète de développement mammaire avec une aménorrhée primaire. Lorsque la disparition des follicules ovariens a lieu pendant ou après la puberté, on observera un développement variable des seins avec une aménorrhée primaire, primo-secondaire ou secondaire, avec ou sans bouffées de chaleur, dyspareunie (cf. Item 58). Les dosages hormonaux mettent en évidence une élévation des concentrations des gonadotrophines, surtout de FSH, avec des taux plasmatiques d’œstradiol souvent bas traduisant l’épuisement complet du capital folliculaire.
Devant toute insuffisance ovarienne primitive ne pouvant être expliquée par une atteinte chirurgicale, une chimiothérapie ou une radiothérapie, il est nécessaire de rechercher en premier lieu une anomalie du caryotype (syndrome de Turner et autres anomalies caryotypiques associées à une insuffisance ovarienne primitive), une anomalie du gène FMR1 (Fragile X Mental Retardation), responsable du syndrome de l’X fragile (encadré), et une atteinte auto-immune.
________________________________________________________________________________
________________________________________________________________________________
Encadré / Item 45 – Spécificités des maladies génétiques, à propos (…) d’une maladie d’instabilité : le syndrome de l’X fragile
Insuffisance ovarienne prématurée (IOP), pré-mutation du gène FMR1 et risque de retard mental lié au syndrome de l’X fragileUne cause fréquente et mal connue d’insuffisance ovarienne primitive (IOP) est la pré-mutation X fragile. Le diagnostic de cette cause d’IOP est essentiel étant donné les risques potentiels pour la descendance, en particulier de sexe masculin.
Rappels
Le syndrome de l’X fragile est la cause la plus fréquente de retard mental héréditaire. Sa prévalence est estimée à un cas pour 3 500 chez les hommes et un cas pour 8 000 chez les femmes. Il se transmet selon une hérédité liée au chromosome X, impliquant qu’il n’y a pas de transmission père-fils mais des mères (conductrices, présymptomatiques ou avec IOP) vers les fils. Cette pathologie a un mode de transmission particulier car le nombre de sujets atteints augmente au fil des générations. L’X fragile est lié à une anomalie du gène FMR1 (Fragile X Mental Retardation 1) situé sur le bras long du chromosome X en Xq27.3 au niveau du locus FRAXA. Le gène FMR1 code la protéine FMRP qui est assez ubiquitaire mais dont le rôle est encore mal défini. Le premier exon du gène FMR1 contient une répétition de triplets CGG. Un sujet normal a de 3 à 50 triplets CGG (l’allèle le plus fréquent contient 30 répétitions) ; dans ce cas, leur transmission est stable d’une génération à l’autre. Les anomalies génétiques responsables de la pathologie correspondent le plus souvent à une expansion instable de ces triplets CGG (maladie dite d’instabilité). En fonction du nombre de répétitions et de leur état de méthylation, on parle de pré-mutation (51 à 199 triplets CGG) ou de mutation complète (200 à plus de 1 000 triplets CGG) ; la mutation complète s’associe à une hyperméthylation des triplets CGG et a pour conséquence l’absence de transcription du gène FMR1.
Une particularité de l’X fragile réside en son mode de transmission avec augmentation de taille de la répétition du triplet CGG à la génération suivante si la transmission est maternelle et absence de modification de taille des triplets si la transmission est paternelle. Le risque de passage de la pré-mutation à la mutation complète lors de la transmission est corrélé à la taille de la pré-mutation maternelle.
Relation entre insuffisance ovarienne prématurée (IOP) et X fragile
Il existe une relation entre la survenue d’une IOP et la présence de la pré-mutation X fragile. La prévalence de la pré-mutation est de 0,8 à 7,5 % chez les femmes présentant une IOP sporadique et de 13 % chez celles ayant une forme familiale (+++).
La recherche de pré-mutation de FMR1 chez toute femme avec IOP de moins de 40 ans doit donc être systématique.
Conseil génétique chez la patiente et sa famille
Chez la patiente avec IOP pour laquelle une pré-mutation de FMR1 a été mise en évidence, il faudra expliquer les conséquences pour elle (risque d’avoir un garçon avec retard mental si elle a une fonction ovarienne résiduelle) et pour sa famille. Il faudra donc proposer un dépistage familial dont le but est de dépister les sujets porteurs asymptomatiques de pré-mutation et de mutations, de calculer chez eux le risque de transmission de la pré-mutation ou de la mutation. Il faut aussi prévenir les femmes asymptomatiques avec pré-mutation ainsi détectées du risque d’IOP et de retard mental chez les enfants en cas de grossesse spontanée.
________________________________________________________________________________
________________________________________________________________________________
C Aménorrhées secondaires associées à une hyperandrogénie
Dans l’immense majorité des cas, il s’agit d’un syndrome des ovaires polymicrokystiques (SOPK) (+++).
Ces anovulations se caractérisent par l’absence de pic cyclique de LH et de sécrétion de progestérone. La sécrétion d’œstradiol persiste mais elle est alors non cyclique, contrairement à une femme normale.
La clinique est dominée par les anomalies du cycle menstruel : aménorrhée, spanioménorrhée depuis les premières règles, ces troubles peuvent alterner chez une même patiente.
Ces troubles du cycle menstruel découlent directement de l’absence de transformation cyclique de l’endomètre hyperplasique en endomètre sécrétoire, apte à la nidation.
1 Anovulations chroniques avec signes d’hyperandrogénie : syndrome des ovaires polykystiques (SOPK) (+++)
Par sa fréquence (5 à 10 % des femmes en âge de procréer), cette maladie constitue une cause majeure d’anovulation (cf. Item 38 – Infertilité du couple).
Sur le plan clinique, l’histoire est caractéristique si elle associe, depuis la puberté, des irrégularités menstruelles suivies d’aménorrhée avec acné et hirsutisme (fig. 7) ; le surpoids est présent dans près de 50 % des cas. L’insulinorésistance est présente dans environ 50 % des cas. Rarement, il existe un acanthosis nigricans, qui témoigne d’une résistance à l’insuline importante — ce signe clinique est péjoratif au plan du pronostic métabolique (risque de diabète gestationnel et de diabète de type 2 : cf. Item 247 et Item 255).
________________________________________________________________________________
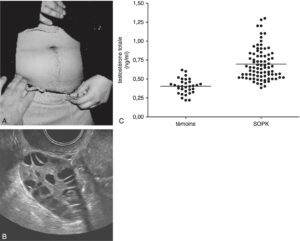
Fig. 7
Syndrome des ovaires polykystiques (SOPK).
A. Hirsutisme. B. Hypertrophie ovarienne multikystique. C. Concentration de testostérone totale chez des patientes avec SOPK comparativement à des femmes normales cyclées prélevées en début de cycle.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
D’après les critères de Rotterdam établis en 2002, sont en faveur d’un SOPK les éléments suivants (+++) :
- deux des éléments sur les trois ci-dessous, suffisants pour établir le diagnostic (+++) :
- hyperandrogénie clinique : séborrhée, acné, hirsutisme, et/ou hyperandrogénie biologique (testostérone circulante élevée) ;
- oligo-/anovulation chronique ;
- hypertrophie ovarienne à l’échographie(volume supérieur à 10 ml), multifolliculaire (classiquement, d’après le consensus de Rotterdam, le seuil en faveur du SOPK est de plus de 20 follicules par ovaire : CFA > 20/ovaire — avec les nouveaux appareils d’échographie) ;
- après exclusion (+++) d’autres causes plus rares d’hyperandrogénie (bloc en 21-hydroxylase modéré dit « non classique » ou « à révélation tardive », tumeur de l’ovaire sécrétant des androgènes, syndrome de Cushing) et d’anovulations secondaires (notamment à une hyperprolactinémie).
2 Aménorrhées d’origine tumorale ovarienne
Toute hyperandrogénie sévère peut être responsable d’une aménorrhée.
Lorsque l’origine est tumorale, il existe souvent en plus de l’hirsutisme des signes de virilisation importants, d’apparition récente : hypertrophie clitoridienne et des masses musculaires, alopécie androgénétique et changement du timbre de la voix qui devient plus grave.
Si la concentration plasmatique de testostérone dépasse 2 à 3 fois la concentration normale, il faut réaliser impérativement une imagerie ovarienne pour détecter une tumeur sécrétant des androgènes.
3 Aménorrhées par pathologie de la surrénale
Le syndrome de Cushing, quelle que soit sa cause, est une étiologie classique d’aménorrhée, qui peut être associée à une hyperandrogénie. Ce diagnostic doit être évoqué devant des signes d’hypercortisolisme (prise de poids, classique obésité faciotronculaire, vergetures pourpres, amyotrophie, etc.) (cf. Item 244 – Adénome hypophysaire).
Les hyperandrogénies surrénaliennes d’origine tumorale responsables d’aménorrhée s’accompagnent très souvent d’une virilisation d’évolution rapide, avec ou sans hypercortisolisme. Une fois évoqué, le diagnostic de tumeur de la surrénale sera facilement confirmé par un scanner des surrénales car ces tumeurs sont dans la majorité des cas volumineuses.
Finalement, un déficit enzymatique de la surrénale en 21-hydroxylase modéré peut se dévoiler par une aménorrhée ou une oligo-/spanioménorrhée accompagnée, comme le SOPK, de signes d’hyperandrogénie.
________________________________________________________________________________
Les formes à révélation tardive de déficits en 21-hydroxylase sont le principal diagnostic différentiel du SOPK.
________________________________________________________________________________
Ce diagnostic sera envisagé d’autant plus que le taux basal prélevé le matin (à distance d’un traitement par les corticoïdes) de 17-hydroxyprogestérone dans le sérum est supérieur à 10 ng/ml. Le diagnostic sera confirmé au plan génétique par le séquençage du gène codant la 21-hydroxylase (CYP21A2), ce qui est essentiel pour le conseil génétique de cette maladie.
D Aménorrhées par anomalie utérine
Les anomalies congénitales du tractus génital pouvant être responsables d’une aménorrhée primaire ne sont pas exceptionnelles. Les signes d’accompagnement seront fonction du siège et du degré de la malformation (fig. 3.8). Une imperforation hyménéale ou une malformation vaginale seront suspectées chez une jeune fille ayant un développement pubertaire normal et des douleurs pelviennes cycliques. Elles seront confirmées par l’examen gynécologique complété par l’imagerie voire une endoscopie des organes génitaux. Une agénésie de l’utérus (fig. 8) sera évoquée devant un tableau similaire sans douleurs.
________________________________________________________________________________
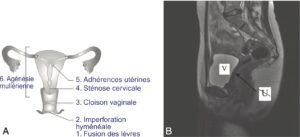
Fig. 8
Aménorrhées par anomalie utérine.
A. Principales causes utérines d’aménorrhée. B. Agénésie utérine (visualisée en IRM) révélée par une aménorrhée primaire.
V, vessie pleine ; U, absence d’utérus.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Le principal problème diagnostique est de faire la différence entre une agénésie müllérienne isolée (avec caryotype 46,XX) et des anomalies sévères de la biosynthèse ou de la réceptivité aux androgènes (avec caryotype 46,XY). On pourra trancher grâce à la mesure de la testostérone plasmatique (concentrations masculines adultes en cas d’insensibilité aux androgènes) et de ses précurseurs qui, anormaux, feront pratiquer un caryotype qui montrera une formule 46,XY et déclencher les analyses moléculaires adaptées.
Les aménorrhées secondaires d’origine utérine sont la conséquence de synéchies utérines secondaires à des gestes traumatiques sur l’utérus (curetages répétés, IVG, chirurgie pour myomes ou césarienne). Plus rarement en France, il peut s’agir d’une tuberculose utérine.
________________________________________________________________________________
Points-clés
- L’aménorrhée : un symptôme que tout médecin doit connaître.
- Chez toute femme normale, après la puberté, avant la ménopause et en dehors de la grossesse, les règles doivent être régulières. C’est-à-dire qu’elles doivent survenir tous les 28 jours en moyenne (la normale est entre 26 et 31 jours). Cette régularité indique que l’utérus, les ovaires, l’hypophyse et l’hypothalamus de la femme fonctionnent normalement et sont donc indemnes d’une maladie.
- On appelle aménorrhée une interruption des règles (aménorrhée secondaire) chez une femme préalablement réglée, ou la non-survenue de règles chez une adolescente (aménorrhée primaire).
- En dehors de la grossesse, de la lactation et de la ménopause, l’aménorrhée est toujours pathologique. Elle doit faire consulter un spécialiste du domaine après en avoir discuté avec le médecin traitant.
- Aucune pilule « pour régulariser les règles » ne doit être prescrite avant d’avoir trouvé la cause de l’aménorrhée. En effet, la pilule œstroprogestative ne fait que provoquer des règles artificielles qui vont rassurer à tort les adolescentes et les femmes. De ce fait, la maladie sous-jacente qui a provoqué l’interruption des règles va continuer à évoluer sans traitement.
- Les aménorrhées ou oligo/spanioménorrhées sont donc le témoin de l’existence d’une maladie de l’utérus, des ovaires, des surrénales ou de la région hypothalamo-hypophysaire.
- Dans la recherche d’une cause d’aménorrhée, certains dosages hormonaux sont essentiels comme les mesures de l’œstradiol et des hormones hypophysairesLH, FSH et la prolactine. On écarte aussi systématiquement une grossesse (+++ : dosage d’hCG dans le sang ou test urinaire de grossesse).
- Les anomalies les plus fréquentes à l’origine d’une aménorrhée ou d’une oligoménorrhée d’origine hypothalamo-hypophysaire sont des tumeurs bénignes ou d’autres lésions de l’hypophyse.
- C’est la raison pour laquelle on est amené, lorsque la LH et FSH sont abaissées, à faire une image de l’hypophyse par IRM. Les adénomes hypophysaires sécrètent souvent de la prolactine qui, lorsqu’elle est à des taux excessifs dans le sang, peut entraîner un écoulement mammaire (galactorrhée), non expliqué par l’allaitement, et s’associe à l’interruption des règles.
- Une autre cause fréquente d’aménorrhée hypothalamique, surtout chez l’adolescente, est une masse grasse insuffisante, qui s’évalue par l’indice de masse corporelle (IMC) : Poids (en kg)/Taille2 (en m2) ; chez ces femmes, l’IMC est inférieur à 21. Cette situation est le plus souvent liée à une restriction alimentaire inappropriée (surtout en matières grasses), fréquemment associée à une activité physique excessive.
- Au niveau ovarien, la plus fréquente des maladies responsables d’oligo- ou aménorrhée est le syndrome des ovaires micropolykystiques. C’est une maladie très fréquente qui touche 5 à 10 % des femmes. Cette affection chronique commence souvent à l’âge de la puberté par l’association très typique que sont l’espacement ou l’interruption des règles avec assez souvent des signes évoquant une sécrétion excessive d’hormones masculines par l’ovaire (testostérone) : acné, séborrhée (peau et cheveux gras) voire hirsutisme (pilosité excessive du visage, « moustache », favoris, des seins, du pubis vers l’ombilic, etc.). Le diagnostic de cette maladie ovarienne fréquente se fait par l’« histoire des règles », jamais régulières (en dehors des phases de la vie sous pilule, avec « règles régulières » artificielles), l’examen, les dosages hormonaux et l’échographie ovarienne.
- Un autre diagnostic de maladie de l’ovaire à poser devant une aménorrhée est l’insuffisance ovarienne prématurée, dont le diagnostic hormonal est en général très facile (élévation de l’hormone FSH plasmatique).
- Enfin, citons les causes utérines plus rares qui peuvent être la conséquence de lésions de l’utérus infectieuses et surtout traumatiques (IVG ou manœuvres chirurgicales après un accouchement difficile).
________________________________________________________________________________
© CEEDMM – Août 2022.
