Item 243 – Hypothyroïdie
________________________________________________________________________
Situations de départ
- 1 Constipation
- 21 Asthénie.
- 26 Anomalies de la croissance staturo-pondérale.
- 33 Difficulté à procréer.
- 40 Écoulement mamelonnaire.
- 51 Obésité et surpoids.
- 57 Prise de poids.
- 63 Troubles sexuels et troubles de l’érection.
- 80 Alopécie et chute des cheveux.
- 94 Troubles du cycle menstruel.
- 113 Puberté précoce ou retardée.
- 118 Céphalée.
- 148 Goitre ou nodule thyroïdien.
- 156 Ronflements.
- 194 Analyse du bilan thyroïdien.
- 195 Analyse du bilan lipidique.
- 200 Dyscalcémie.
- 202 Dysnatrémie.
- 225 Découverte d’une anomalie cervico-faciale à l’examen d’imagerie médicale.
- 252 Prescription d’un hypolipémiant.
- 266 Consultation de suivi d’un patient polymédiqué.
- 279 Consultation de suivi d’une pathologie chronique.
- 284 Consultation de suivi et éducation thérapeutique d’un patient avec hypothyroïdie.
- 306 Dépistage et prévention ostéoporose.
- 320 Prévention des maladies cardiovasculaires.
- 328 Annonce d’une maladie chronique.
- 352 Expliquer un traitement au patient (adulte, enfant, adolescent).
- 354 Évaluation de l’observance thérapeutique.
________________________________________________________________________________
________________________________________________________________________________
Hiérarchisation des connaissances
________________________________________________________________________________
| Rang | Rubrique | Intitulé |
| A | Définition | Définition de l’hypothyroïdie |
| B | Prévalence, épidémiologie | Connaître la prévalence de l’hypothyroïdie |
| B | Éléments physiopathologiques | Connaître la physiopathologie de la thyroïdite de Hashimoto |
| A | Diagnostic positif | Connaître les signes cliniques d’une hypothyroïdie |
| A | Diagnostic positif | Connaître les anomalies des dosages hormonaux |
| B | Diagnostic positif | Connaître les signes biologiques spécifiques et non spécifiques |
| B | Prévalence, épidémiologie | Connaître les complications liées à l’hypothyroïdie |
| B | Prévalence, épidémiologie | Connaître les facteurs de risque de l’hypothyroïdie |
| A | Étiologie | Connaître les principales étiologies des hypothyroïdies |
| A | Prise en charge | Connaître le principe de l’hormonothérapie substitutive dans l’hypothyroïdie |
| A | Prise en charge | Comprendre les spécificités thérapeutiques du traitement de l’hypothyroïdie chez le sujet âgé et/ou coronarien |
________________________________________________________________________________
Hypothyroïdie
- Définition et prévalence de l’hypothyroïdie
- Séméiologie de l’hypothyroïdie
- Étiologie des hypothyroïdies
- Traitement
I Définition et prévalence de l’hypothyroïdie
A Définition
L’hypothyroïdie se définit par une insuffisance de sécrétion des hormones thyroïdiennes qui peut être due à :
- Une atteinte de la glande thyroïde elle-même, appelée insuffisance thyroïdienne primitive ou hypothyroïdie primaire ou hypothyroïdie périphérique :
- le diagnostic d’atteinte primaire de la glande thyroïde repose sur une augmentation de la TSH (par levée du rétrocontrôle négatif des hormones thyroïdiennes sur les cellules thyréotropes) ;
- dans un second temps, si la TSH est élevée, afin de mesurer la sévérité du déficit sécrétoire, on dose la thyroxine libre (T4L ou fT4) (plutôt que la T4 totale, qui est sujette à de multiples variations) :
- si la T4L est normale, il s’agit d’une hypothyroïdie primaire fruste (ou hypothyroïdie infraclinique) ; dans ce cas, la TSH est peu élevée, le plus souvent entre 4 et 10 mUI/l ;
- si la T4L est basse, il s’agit d’une hypothyroïdie primaire patente ; la TSH est alors plus élevée, supérieure à 10 mUI/l.
- Une atteinte hypothalamo-hypophysaire appelée insuffisance thyréotropeou hypothyroïdie secondaire ou hypothyroïdie centrale :
- il est conseillé d’utiliser de préférence le terme insuffisance thyréotrope pour ne pas engendrer de confusion dans la prise en charge des patients, en particulier thérapeutique ;
- le diagnostic d’atteinte hypothalamo-hypophysairerepose sur le couple T4L/TSH :
- la T4L est toujours basse (inférieure au seuil bas de la normalité) ;
- la TSH est inadaptée au niveau de T4L :
- soit basse ou normale, ce qui témoigne logiquement de l’origine hypophysaire ;
- soit légèrement élevée mais inférieure à 10–12 mUI/l : cela peut sembler illogique pour une origine haute mais cela s’explique par le fait que la TSH est immunoréactive (donc dosable) mais biologiquement inactive ; elle contraste avec une T4L franchement basse. Ce tableau biologique évoque plutôt une atteinte hypothalamique.
________________________________________________________________________________
Une TSH faiblement élevée (4 à 10 mUI/l) peut donc faire faussement conclure à une hypothyroïdie primaire fruste si la T4L n’est pas dosée — en cas d’insuffisance thyréotrope la T4L sera basse, alors qu’en cas d’hypothyroïdie fruste infraclinique elle sera normale. Une TSH normale ne permet pas d’éliminer une insuffisance thyréotrope.
________________________________________________________________________________
B Prévalence
1 Hypothyroïdie primaire
L’hypothyroïdie primaire est la plus fréquente mais la forme patente est devenue rare (< 2 %). La prévalence de l’hypothyroïdie fruste est plus importante chez les femmes (7,5 % des femmes contre 3 % des hommes), chez les sujets âgés (10 %), en cas de syndrome de Turner ou de trisomie 21 ou en association avec le diabète de type 1 dans le cadre d’une polyendocrinopathie auto-immune.
Actuellement, par la généralisation du dosage de TSH (bilan systématique ou devant une asthénie), le diagnostic est le plus souvent précoce, porté au stade d’hypothyroïdie fruste où seule la TSH est augmentée.
La prévalence de l’hypothyroïdie fruste peut être surestimée car :
- la TSH augmente avec l’âge et il n’existe pas de seuils consensuels ;
- la TSH peut s’élever en situation d’obésité (élévation fonctionnelle et qui se normalise avec la perte de poids).
________________________________________________________________________________
Un seul dosage de TSH modérément augmenté sans bilan étiologique n’est pas suffisant pour porter le diagnostic d’hypothyroïdie primaire et donc justifier un traitement.
________________________________________________________________________________
2 Insuffisance thyréotrope
L’insuffisance thyréotrope est beaucoup plus rare que l’hypothyroïdie primaire. Elle constitue moins de 5 % des hypothyroïdies.
Elle s’inscrit souvent dans un contexte de pathologie hypophysaire (cf. infra, « Étiologie ») ou cérébrale évocatrice qui aide au diagnostic. C’est une situation rarement observée en pratique médicale courante.
II Séméiologie de l’hypothyroïdie
A Symptômes généraux de l’hypothyroïdie primaire
La séméiologie de l’hypothyroïdie est fonction de sa profondeur, de son ancienneté et de son origine (périphérique ou centrale) et est très peu spécifique.
L’hypothyroïdie fruste est la forme la plus fréquente de nos jours. Les symptômes sont modestes ou absents.
La sémiologie de l’hypothyroïdie profonde, rarement rencontrée de nos jours, comporte :
- un syndrome d’hypométabolisme: asthénie physique et psycho-intellectuelle, somnolence, hypothermie, frilosité acquise, constipation acquise (à différencier de symptômes anciens), bradycardie, prise de poids modeste contrastant parfois avec une perte d’appétit ;
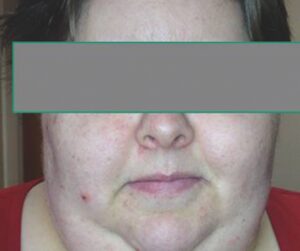
- une atteinte cutanée et des phanères (fig. 1) : la peau est pâle ou jaunâtre (carotinodermie par baisse de transformation du carotène en vitamine A), sèche et squameuse, dépilée (axillaire, pubienne, queue des sourcils), la transpiration est diminuée, les cheveux sont secs et cassants, les lèvres peuvent être cyanosées ;
________________________________________________________________________________
Fig. 14.1.
Patiente hypothyroïdienne.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
- un myxœdème cutanéomuqueux: la peau est infiltrée et épaissie, en particulier au niveau :
- de la face dorsale des mains (syndrome du canal carpien) et des pieds, des paupières (le matin au réveil surtout) et de l’ensemble du visage, pouvant donner un aspect de « faciès lunaire » ;
- laryngée (voix rauque), de la trompe d’Eustache (hypoacousie), de la langue (macroglossie et ronflements) ;
- une atteinte neuromusculaire :
- un enraidissement, des crampes et myalgies ;
- plus rarement : tendinites, arthralgies, neuropathies périphériques, syndrome cérébelleux ;
- un retentissement endocrinien :
- une galactorrhée, rare (hyperprolactinémiepossible en cas d’hypothyroïdie primaire profonde, avec TSH > 50 mUI/l, mais en fait très rare) ;
- des troubles des règles (oligoménorrhée, ménorragies, anovulation) ;
- des troubles de la libido.
B Symptômes généraux de l’insuffisance thyréotrope
Les symptômes sont superposables, en dehors des symptômes de myxœdème présents uniquement en situation d’hypothyroïdie primaire.
C Complications
Les formes compliquées sont rares, le diagnostic étant maintenant souvent fait précocement lors d’un dosage systématique de TSH.
1 Formes cardiovasculaires
Il peut s’agir :
- d’une atteinte fonctionnelle :
- modification de l’activité et du métabolisme du muscle cardiaque : bradycardie sinusale, diminution de la force contractile (baisse de l’action chronotrope et inotrope positive) ;
- insuffisance cardiaque et troubles du rythme ventriculaire (rarement) ;
- d’une infiltration (dans l’hypoparathyroïdie primaire) : épanchement péricardique (bruits du cœur assourdis à l’auscultation, cardiomégalie sur la radiographie thoracique, microvoltage et troubles diffus de la repolarisation sur l’ECG) ; l’échographie cardiaque permet de confirmer le diagnostic ; l’épanchement péricardique s’accompagne d’un épanchement pleural ou péritonéal ;
- d’une coronaropathie: l’hypothyroïdie favorise l’athérome coronarien, entre autres par l’hypercholestérolémie induite (élévation du LDL-cholestérol) ; les symptômes d’insuffisance coronarienne peuvent se démasquer lors de l’institution du traitement substitutif, qui sera donc prudent chez le sujet fragilisé.
2 Formes neuromusculaires et neuropsychiques
Il peut être observé :
- un état dépressif, un syndrome confusionnel ou une démence, plus fréquents chez le sujet âgé ;
- une myopathie proximale (CPK élevées) ;
- des apnées du sommeil.
3 Coma myxœdémateux
De nos jours, le coma myxœdémateux est rare. Il survient en cas d’hypothyroïdie primaire profonde (TSH > 50 mUI/l, T4L effondrée), ancienne, volontiers en période hivernale et est favorisé par une agression (infection, chirurgie, traitement sédatif ou antidépresseur). Il se traduit par un coma calme hypotonique et hypothermique, associé à avec bradycardie, une bradypnée, une hypotension ; les réflexes ostéotendineux sont lents et décomposés ; il n’y a pas de signe de localisation neurologique. L’hyponatrémie (de dilution) est constante. Le pronostic est sévère.
D Palpation de la glande thyroïde
Les caractéristiques cliniques de la palpation de la glande thyroïde dépendent de l’étiologie de l’hypothyroïdie.
La thyroïde est souvent ferme et hétérogène, pseudonodulaire en cas de maladie auto-immune thyroïdienne. Elle peut être augmentée de volume en cas de maladie de Hashimoto. Elle peut être de taille normale ou diminuée pour les autres thyroïdites auto-immunes.
Elle peut être à peine palpable en cas de thyroïdite atrophique ou en insuffisance thyréotrope.
E Cas particulier : hypothyroïdie durant la grossesse
1 Complications maternelles
L’hypothyroïdie non supplémentée durant la grossesse peut occasionner une hypertension artérielle, une prééclampsie, une fausse couche, une hémorragie du post-partum.
2 Complications fœtales
Au premier trimestre de la grossesse, la thyroïde fœtale n’est pas fonctionnelle ; le développement du système nerveux fœtal est donc dépendant des hormones maternelles durant cette période. Ainsi, l’hypothyroïdie maternelle peut engendrer des troubles du développement neuro-intellectuel de l’enfant (même en cas d’hypothyroïdie maternelle fruste) ; une hypotrophie est également possible.
3 Particularités biologiques de la femme enceinte
Au premier trimestre d’une grossesse normale, la TSH est abaissée (en raison de l’action « TSH-like » de l’hCG) et la T4L souvent à la limite supérieure de la normale. Dans un second temps, alors que la TSH se normalise, la T4L peut baisser et rester basse durant toute la durée de la grossesse. Ce profil biologique (TSH normale et T4L basse) peut faire conclure à tort à une insuffisance thyréotrope. Comme toujours et surtout pendant la grossesse, le diagnostic d’hypothyroïdie primaire repose sur une élévation de la TSH.
F Anomalies biologiques non spécifiques
1 Anomalies hématologiques
L’hypothyroïdie peut être associée à une anémie normocytaire et normochrome, plus rarement macrocytaire. Lorsqu’elle est macrocytaire, l’anémie peut être le fait d’une maladie de Biermer associée, dans le cadre d’une polyendocrinopathie auto-immune. Une maladie de Biermer doit être suspectée si la macrocytose ne régresse pas avec le traitement de l’hypothyroïdie. En cas de carence martiale, il faut penser à une maladie cœliaque associée.
2 Anomalies ioniques et métaboliques
- Une hyponatrémie est possible en cas d’hypothyroïdie patente : elle entre dans le cadre nosologique des hyponatrémies hypo-osmolaires normovolémiques par sécrétion appropriée (réactionnelle) d’ADH.
- Une hypercholestérolémie (élévation du LDL-cholestérol), qui est quasi constante en cas d’hypothyroïdie patente ;
- Une hypertriglycéridémie (VLDL), plus rare, par diminution de la dégradation des lipoprotéines ;
- Une augmentation des enzymes musculaires (CPK), par infiltration des fibres musculaires, avec parfois augmentation des ASAT.
III Étiologie des hypothyroïdies
A Étiologie de l’hypothyroïdie primaire
(Cf. tableau 1.)
________________________________________________________________________________
Tableau 1.
Étiologie des hypothyroïdies. (Source : CEEDMM, 2021.)
| Étiologie des hypothyroïdies primaires | Étiologie des insuffisances thyréotropes |
| Thyroïdites lymphocytaires :
• thyroïdite atrophique • thyroïdite de Hashimoto
Iatrogènes : • post-iode radioactif • post-radiothérapie • traitement médicamenteux :surcharge en iode, immunothérapie (anti-PD1/anti-PDL1 ++) • défaut d’adaptation des antithyroïdiens de synthèse Congénitale : • ectopie et athyréose • anomalie de l’hormonosynthèse Thyroïdite de Riedel (exceptionnel) Séquelles de thyroïdite de De Quervain Carence en iode Infiltration métastatique ou autre (hémochromatose) |
Tumeurs compressives de la région hypothalamo-hypophysaire ou maladies infiltratives (granulomatoses)
Atteinte lésionnelle : traumatisme crânien, méningite, hémorragie méningée
Iatrogènes : radiothérapie de la région hypothalamo-hypophysaire, immunothérapie (anti-CTLA4), bexarotène (traitement du lymphome cutané)
Congénitales (le plus souvent déficit hypophysaire combiné)
|
________________________________________________________________________________
1 Thyroïdites auto-immunes, ou thyroïdites chroniques lymphocytaires (+++)
Thyroïdite de Hashimoto
Définition, clinique
La thyroïdite de Hashimoto se caractérise par un goitre ferme et irrégulier et la présence d’anticorps anti-thyroperoxydase (anti-TPO)circulants, à des taux qui peuvent être très élevés. Plus rarement, en cas de négativité des anticorps anti-TPO, la présence d’anticorps anti-thyroglobuline (anti-Tg) permet d’affirmer le diagnostic.
Elle est due à une infiltration lymphocytaire du parenchyme thyroïdien secondaire à une réaction auto-immune survenant sur un terrain génétique particulier et est probablement favorisée par des facteurs environnementaux (mal connus). Elle peut être isolée ou s’intégrer dans le contexte d’une polyendocrinopathie auto-immune, de type 2 (fréquemment associée au diabète et/ou au vitiligo et/ou à la maladie de Biermer) bien plus souvent que de type 1 (dont les principales maladies sont l’hypoparathyroïdie et l’insuffisance surrénale lente).
Initialement euthyroïdienne et asymptomatique (TSH normale), la thyroïdite évolue au cours du temps vers l’hypothyroïdie par destruction progressive des thyréocytes (élévation progressive de la TSH).
Au décours de l’évolution d’une thyroïdite, la croissance rapide du goitre ou d’une zone pseudonodulaire doit faire évoquer un lymphome — qui ne complique toutefois que moins de 1 % des thyroïdites auto-immunes.
Examens complémentaires
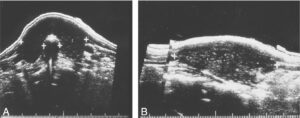
L’échographie thyroïdienne permet d’avoir des arguments étiologiques et de repérer d’éventuelles anomalies nodulaires. L’aspect échographique habituel des thyroïdites est globalement hypoéchogène et hétérogène avec des zones hyperplasiques pseudonodulaires hyperéchogènes (fig. 2). La vascularisation est hétérogène, souvent un peu augmentée en début d’évolution.
________________________________________________________________________________
La scintigraphie thyroïdienne ne doit pas être réalisée.
________________________________________________________________________________
________________________________________________________________________________
Fig. 2.
Aspect échographique d’une thyroïdite auto-immune.
A. Coupe transversale. B. Coupe sagittale.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Thyroïdite auto-immune du post-partum
Elle présente les mêmes mécanismes auto-immuns avec souvent un petit goitre.
Elle se traduit par une phase de thyrotoxicose initiale transitoire (vers les 2 mois post-partum), qui peut passer inaperçue, puis l’évolution se fait vers l’hypothyroïdie (3e au 6e mois post-partum). L’hypothyroïdie est habituellement transitoire et résolutive dans l’année, mais peut être définitive. La thyroïdite du post-partum est souvent non diagnostiquée, les symptômes qu’elle occasionne étant attribués aux conséquences de la grossesse et au manque de sommeil. Elle concerne 5 % des grossesses et est plus fréquente chez les patientes ayant une auto-immunité thyroïdienne sous-jacente.
2 Thyroïdites iatrogènes
Elles sont souvent « silencieuses » mais peuvent être douloureuses.
Elles sont secondaires à une réaction inflammatoire induite par la radiothérapie cervicale ou, plus fréquemment, la prise de certains médicaments comme :
- les traitements des cancers par anti-tyrosine kinase ou par immunothérapies et check-point inhibiteurs ;
- les traitements iodés : amiodarone, produits de contraste iodés, iode radioactif : une thyroïdite peut survenir plusieurs années après le traitement d’une hyperthyroïdie ou d’un goitre, d’où la nécessité d’un dosage annuel de TSH ;
- les interférons : hépatites virales (+++), sclérose en plaques… (actuellement moins utilisés) ;
- le lithium: il entraîne rarement une hypothyroïdie mais fréquemment un goitre.
En cas de radiothérapie cervicale pour cancer du larynx ou lymphome, etc., une thyroïdite peut survenir plusieurs années après, d’où la nécessité d’un dosage annuel de TSH.
3 Autres causes d’hypothyroïdie primaire
- La carence iodée sévère est une étiologie fréquente en zone endémique : elle occasionne une hypothyroïdie sévère et profonde associée à un retentissement neurocognitif majeur (« crétinisme goitreux ») et un goitre, parfois monstrueux.
- Hypothyroïdie congénitale (encadré).
________________________________________________________________________________
Encadré – Hypothyroïdie congénitale
En France, l’hypothyroïdie néonatale est systématiquement dépistée à la naissance ; elle représente un cas pour 3 500 des naissances. Cependant, la fréquence a augmenté sur les dernières décennies, principalement en raison d’une évolution du seuil de TSH, pour atteindre un cas pour 2 500 naissances sur les dernières années.
Le dépistage néonatal de l’hypothyroïdie congénitale est réalisé de manière systématique dans les heures suivant la naissance, par ponction capillaire au niveau du talon : quelques gouttes de sang sont déposées sur papier buvard pour mesure de la TSH. Seules les hypothyroïdies primaires sont dépistées ainsi.
Une information claire et compréhensible doit être donnée aux parents.
Les principales causes d’hypothyroïdies congénitales sont les dysgénésies thyroïdiennes (athyréose et thyroïde ectopique) et les hypothyroïdies avec « glande en place » (hypoplasie de la thyroïde ou goitre par trouble de l’hormonogenèse).
Avant l’ère du dépistage, cette affection était responsable, en l’absence de traitement, d’un retard psychomoteur important et irréversible, et d’une ostéodystrophie avec retard de croissance.
Depuis le dépistage, les enfants sont vus à l’âge de quelques jours et la clinique de l’hypothyroïdie est alors discrète : ictère prolongé, constipation, hypotonie, pleurs rauques, difficulté à la succion, fontanelles larges (en particulier la postérieure), hypothermie.
________________________________________________________________________________
4 Démarche diagnostique devant une hypothyroïdie primaire
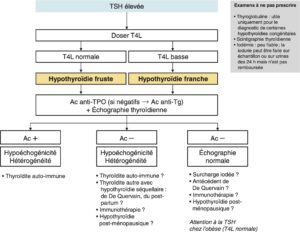
La démarche diagnostique est résumée dans la figure 3.
________________________________________________________________________________
Fig. 3.
Démarche diagnostique devant une hypothyroïdie primaire.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
5 Facteurs de risque de l’hypothyroïdie primaire
Les facteurs de risque peuvent se décliner en miroir des étiologies. Ils aident au diagnostic étiologique en cas de découverte d’une hypothyroïdie ou à penser au dépistage :
- terrain d’auto-immunité familial ou personnel déjà connu ou terrain prédisposant à l’auto-immunité (syndrome de Turner, déficits immunitaires combinés…) ;
- exposition à un agent physique ou médicamenteux connu pour altérer la fonction thyroïdienne : radiothérapie cervicale (cancers ORL, lymphomes), médicament iodé, immunothérapie ;
- atteinte du parenchyme thyroïdien par une thyroïdite lytique (avec thyrotoxicose initiale) : de De Quervain, thyroïdites iodées…
B Étiologie et facteurs de risque de l’insuffisance thyréotrope
(Cf. tableau 1.)
Les principales causes de l’insuffisance thyréotrope sont les suivantes :
- compression de la région hypothalamo-hypophysaire par une tumeur : adénome hypophysaire le plus souvent,mais aussi craniopharyngiome, méningiome… (cf. Item 244 – Adénome hypophysaire) ;
- infiltration de la région hypothalamo-hypophysaire : granulomatoses, lymphomes… ;
- iatrogènes : séquelles post-chirurgicales ou post-radiothérapie de tumeurs de la région hypothalamo-hypophysaire, traitement du lymphome cutané (bexarotène), immunothérapie(anti-CTLA4) ;
- séquelles de méningite, de traumatisme crânien, d’hémorragie méningée, d’apoplexie hypophysaire, de nécrose hémorragique hypophysaire du post-partum (syndrome de Sheehan), d’hypophysite lymphocytaire (souvent dans le post-partum) ;
- génétique
Le diagnostic étiologique est orienté par l’IRM, qui est à réaliser systématiquement.
En fait, l’insuffisance thyréotrope est rarement isolée et c’est souvent devant un syndrome tumoral de la région sellaire, après traitement d’une maladie hypothalamo-hypophysaire ou devant des symptômes évocateurs d’hypopituitarisme, qu’est découverte une insuffisance thyréotrope.
Ces différentes pathologies constituent les facteurs ou plutôt les situations à risque de l’insuffisance thyréotrope : il faut y penser devant les atteintes méningées et les traumatismes crâniens, situations moins spontanément évocatrices d’insuffisance hypophysaire.
IV Traitement
A Moyens et objectifs thérapeutiques
Le traitement repose sur l’emploi de T4, commercialisée sous forme de lévothyroxine (L-T4) : Lévothyrox®, Euthyrox®, L-Thyroxin® Henning, Thyrofix® ou TCaps®, comprimés à 25, 50, 75, 88*, 100, 112*, 125, 137* 150, 175, 200 μg (*selon les laboratoires). Dans de rares indications, il est possible d’employer la L-Thyroxine® solution buvable (1 goutte = 5 μg) ou TSoludose® (rarement utilisée chez l’adulte) ou solution injectable (ampoule de 200 μg) — en cas de coma myxœdémateux ou d’impossibilité à avaler.
La T4 peut être associée à la T3 dans l’Euthyral® et la T3 peut être utilisée seule (Cynomel®), mais les indications sont devenues rares et discutées.
Les besoins en hormones thyroïdiennes sont en moyenne de 1 à 1,5 μg/kg par jour mais ils sont fonction de la profondeur de l’hypothyroïdie.
1 Hypothyroïdie primaire
Le bon équilibre thérapeutique d’une hypothyroïdie primaire s’apprécie sur la TSH, seule. La valeur normale de TSH est inférieure à 4 mUI/l. Toutefois, la TSH se situe plutôt entre 0,4 et 2,5 mUI/l chez la majorité des personnes (95es percentiles des sujets témoins sans goitre visible ni antécédents de pathologie thyroïdienne, sans anticorps antithyroïdiens détectables et sans médicaments pouvant interférer avec la fonction thyroïdienne). Ainsi, les objectifs sont les suivants :
- en situation standard et pour une parfaite euthyroïdie : TSH entre 0,5 et 2,5 mUI/l ;
- en cas de coronaropathie non contrôlée, chez les personnes très âgées : ne pas normaliser la TSH mais la stabiliser entre 4 et 10 mUI/l, selon la tolérance ; en pratique, chez les coronariens, on traite d’abord la coronaropathie puis on normalise la TSH ;
- chez la femme enceinte : la TSH doit être entre 0,5 et 2,5 mUI/l.
Dans tous les cas, le surdosage chronique en lévothyroxine doit être évité du fait des risques osseux et cardiovasculaires de la thyrotoxicose.
La TSH sera contrôlée 6 à 8 semaines après le début du traitement (ou 6 à 8 semaines après avoir atteint la posologie théoriquement efficace en cas de traitement progressif). La contrôler trop tôt amènerait à des augmentations trop rapides des posologies de lévothyroxine et donc à un risque de surdosage. Une fois l’objectif de TSH obtenu, elle est contrôlée à 6 mois puis annuellement.
2 Insuffisance thyréotrope
Les modalités thérapeutiques sont identiques mais la surveillance biologique différente. La TSH ne doit pas être utilisée pour surveiller et adapter le traitement. En effet, en cas d’insuffisance thyréotrope, la TSH est souvent effondrée mais elle peut être aussi normale, ce qui peut induire en erreur.
La surveillance et l’adaptation du traitement reposent donc ici seulement sur le dosage de la T4L, qui peut être contrôlée après 15 à 21 jours de traitement mais à jeun sans avoir pris la L-thyroxine (pic plasmatique post-prise).
Pour que l’insuffisance thyréotrope soit bien substituée, la T4L doit être dans le milieu ou dans le tiers supérieur de la normale, chez un patient sans antécédent coronarien ou de moins de 70 ans sans facteur de risque cardiovasculaire.
Il n’y a pas de consensus chez les patients âgés.
3 Précautions de substitution
Chez un patient très âgé, coronarien ou susceptible de l’être, la posologie initiale de lévothyroxine est de 12,5 μg par jour à 25 μg par jour ; elle est progressivement augmentée par paliers de 12,5 à 25 μg toutes les 1 à 2 semaines jusqu’à l’obtention de la dose théoriquement efficace.
Le risque de démasquer une coronaropathie est d’autant plus important que l’hypothyroïdie est profonde et ancienne. La surveillance doit donc être adaptée à la situation :
- prévenir le patient âgé ou le coronarien contrôlé qu’il doit consulter en cas de douleurs thoraciques ;
- chez le coronarien grave, faire pratiquer un ECG hebdomadaire si possible ;
- le coronarien non contrôlé sera éventuellement hospitalisé pour surveillance clinique et électrographique quotidienne lors de l’institution du traitement.
Les bêtabloquants peuvent parfois être utiles associés à la lévothyroxine.
B Situations cliniques
1 Hypothyroïdie fruste (« infraclinique »)
En dehors de la grossesse, il est recommandé de distinguer trois situations :
- risque élevé de conversion en hypothyroïdie patente (TSH > 10 mUI/l et/ou présence d’anticorps anti-TPO) : le traitement est recommandé ;
- risque faible de conversion en hypothyroïdie patente (TSH < 10 mUI/l et absence d’anticorps anti-TPO) : il est recommandé de surveiller la TSH à 6 mois puis tous les ans ;
- risque intermédiaire de conversion en hypothyroïdie patente (TSH < 10 mUI/l mais présence d’anticorps anti-TPO, présence de signes cliniques d’hypothyroïdie, présence d’une hypercholestérolémie) : l’instauration d’un traitement peut se discuter.
En cas d’hypothyroïdie fruste, les besoins en hormones thyroïdiennes sont inférieurs et se situent entre 25 et 75 μg par jour.
Dans le cas de la grossesse, le traitement par lévothyroxine est justifié dès lors que la TSH est ≥ 3 mUI/l. L’objectif est de maintenir la TSH entre 0,5 et 2,5 mUI/l.
2 Survenue d’une grossesse chez une femme hypothyroïdienne connue
Au cours du premier trimestre de la grossesse, les besoins en lévothyroxine augmentent d’environ 25 à 50 %. Les posologies doivent donc être augmentées dès le diagnostic de grossesse, puis la TSH doit être surveillée tous les mois pour la maintenir entre 0,5 et 2,5.
3 Traitements intercurrents ou pathologies nécessitant d’augmenter la lévothyroxine
L’utilisation de certains médicaments nécessite une augmentation des doses de lévothyroxine, afin de maintenir la TSH dans les objectifs. Trois mécanismes peuvent être en cause :
- interférences avec l’absorption intestinale de la T4 :
- sulfate de fer (attention chez la femme enceinte) ;
- carbonate de calcium ;
- inhibiteurs de la pompe à proton ;
- magnésium ;
- pathologies induisant une malabsorption : maladie cœliaque(y penser en cas de thyroïdite auto-immune difficile à équilibrer), gastrite a Helicobacter pylori, gastrite atrophique (acidité gastrique nécessaire à l’absorption), chirurgie bariatrique… ;
- augmentation de la clairance de la T4 ;
- augmentation de la liaison des hormones thyroïdiennes à leur protéine porteuse (TBG), qui diminue la fraction des hormones circulantes libres : traitement œstrogénique (attention lors de l’instauration ou de l’arrêt d’un traitement hormonal de la ménopause).
4 Hypothyroïdie néonatale
La prise en charge repose sur la prescription quotidienne substitutive à vie de L-thyroxine, initialement à une posologie supérieure ou égale à 10 μg/kg par jour.
La mise en route précoce du traitement (avant 12–15 jours) et à posologie adéquate (> 10 μg/kg par jour) a transformé le pronostic de cette affection : il n’y a plus de retard mental et la croissance est normale.
________________________________________________________________________________
Faut-il dépister l’hypothyroïdie acquise ?
Des recommandations ont été émises par l’HAS et la Société française d’endocrinologie en 2007 (fig. 4).
Population générale
« Il n’y a pas lieu de réaliser un dépistage systématique de l’hypothyroïdie fruste. Un dépistage ciblé est indiqué en cas de situation à risque :
- femme âgée de plus de 60 ans ayant des antécédents thyroïdiens ;
- présence d’anticorps antithyroïdiens ;
- antécédents de chirurgie ou d’irradiation thyroïdienne ou cervicale ;
- traitements à risque thyroïdien (amiodarone, lithium, interféron ou autres cytokines). »
Cas particulier de la grossesse et du post-partum
« Un dépistage ciblé est indiqué devant :
- signes cliniques évocateurs, tel un goitre ;
- contexte auto-immun, tel un diabète de type 1 ;
- contexte thyroïdien personnel ou familial : antécédents personnels ou familiaux de dysthyroïdie, d’intervention chirurgicale sur la thyroïde, notion d’élévation des anticorps antithyroïdiens. »
L’hypothyroïdie fruste pourrait être associée à une augmentation du risque d’hématome rétroplacentaire, de prématurité et de détresse respiratoire néonatale. Contrairement à l’hypothyroxinémie maternelle franche, elle n’est pas associée à une altération démontrée des fonctions cognitives ou du développement psychomoteur de l’enfant. Certaines études l’évoquent cependant, d’où la grande rigueur nécessaire chez la femme enceinte.
________________________________________________________________________________
________________________________________________________________________________
Fig. 14.4.
Recommandations pour le dépistage de l’hypothyroïdie fruste.
(D’après : Hypothyroïdies frustes chez l’adulte : diagnostic et prise en charge. HAS-SFE, avril 2007.)
(Source : CEEDMM, 2021.)

________________________________________________________________________________
________________________________________________________________________________
Points-clés
- Le diagnostic d’hypothyroïdie primaire est posé sur l’élévation de la TSH. Sa prévalence est environ de 2 % de la population générale. L’hypothyroïdie primaire est plus fréquente chez la femme que chez l’homme. Sa prévalence augmente avec l’âge surtout au-delà de 65 ans. Le coma myxœdémateux est exceptionnel.
- L’insuffisance thyréotrope, beaucoup plus rare (moins de 5 % des hypothyroïdies) ; elle est diagnostiquée par une T4L basse avec TSH inadaptée.
- Les signes cliniques de l’hypothyroïdie sont nombreux, variés, non spécifiques et inconstants ; il faut donc penser à l’hypothyroïdie primaire facilement et demander le dosage de la TSH. Les examens demandés en seconde intention sont utiles au diagnostic étiologique : anticorps anti-TPO (et anti-Tg si les anti-TPO sont négatifs) et échographie.
- Dans la thyroïdite d’Hashimoto, les taux d’anticorps anti-TPO sont souvent très élevés et on retrouve un goitre ferme, nodulaire. La présence d’autres maladies auto-immunes est à rechercher dans la famille et chez le patient.
- La thyroïdite atrophique, après 50 ans, est une étiologie fréquente, d’évolution lente, avec présence fréquente d’anticorps anti-TPO à des taux modérés.
- L’existence de thyroïdites iatrogènes par médicaments iodés (amiodarone, etc.), après traitement par l’iode 131 ou radiothérapie cervicale, justifie le contrôle annuel de la TSH.
- L’hypothyroïdie est le plus souvent due à une thyroïdite auto-immune (54 %), à une cause médicamenteuse (15 %), en particulier au décours d’une surcharge en iode (surtout chez les patients ayant un apport iodé suffisant).
- Le traitement repose sur la lévothyroxine (L-T4) à visée substitutive, avec un suivi :
- de la TSH à 4–8 semaines jusqu’à obtention de l’euthyroïdie, puis un suivi annuel ;
- ou de la T4L en cas d’insuffisance thyréotrope.
- La prise en charge thérapeutique de l’hypothyroïdie subclinique a deux objectifs principaux : prévenir les conséquences néonatales chez la femme enceinte (démontré) et prévenir les risques cardiovasculaires à long terme (discuté).
________________________________________________________________________________
© CEEDMM – Août 2022.
