Complications dégénératives et métaboliques du diabète
La souffrance vasculaire au cours du diabète concerne l’intégralité des vaisseaux de l’organisme, quels que soient leur taille et les tissus qu’ils irriguent. Cette souffrance a parfois une traduction clinique : on distingue classiquement les complications microangiopathiques (rein, œil, nerf) des complications macroangiopathiques, qui consistent en une athérosclérose accélérée, avec certaines spécificités. La présence d’un diabète augmente considérablement plus le risque d’artériopathie oblitérante des membres inférieurs (augmentation de 6 à 10 fois), que celui de coronaropathie (augmentation de 2 à 4 fois) ou d’accident vasculaire cérébral ischémique (2 fois).
L’hyperglycémie chronique est la force motrice de ces complications, de façon majeure pour les complications microangiopathiques et de façon importante, au même titre que l’hypertension artérielle, la dyslipidémie ou le tabagisme, pour les complications macroangiopathiques (+++).
La prévention et la prise en charge des complications du diabète de type 2 intéressent les médecins généralistes en premier lieu, mais il faut rappeler que l’avis du diabétologue est recommandé en cas de complications du diabète (Guide Parcours de soins, HAS, 2014).
I Physiopathologie des complications vasculaires
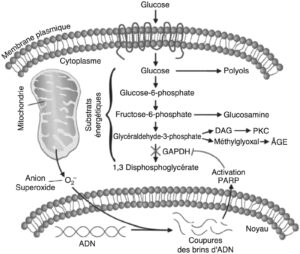
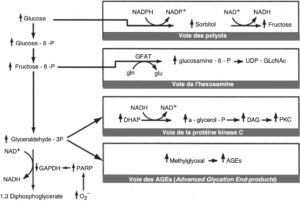
Bien que secondaire à un facteur unique, l’hyperglycémie, la physiopathologie des complications vasculaires ne se résume pas à une voie biochimique pathologique. De plus, des anomalies associées (par exemple, une dyslipidémie fréquente) exercent leurs propres effets, isolément ou en synergie avec ceux de l’hyperglycémie. La physiopathologie des complications combine une agression des vaisseaux, surtout patente au niveau endothélial, et des mécanismes cellulaires de défense ou de réparation (fig. 1). Plusieurs mécanismes physiopathologiques sont impliqués et intriqués : production d’espèces oxydantes, inflammation, activation de systèmes vasoactifs comme le système rénine-angiotensine-aldostérone, activation de phénomènes de réparation tissulaire, mise en jeu de voies métaboliques intracellulaires accessoires… (fig. 2).
________________________________________________________________________________
Fig. 1.
Processus fondamental de la physiopathologie des complications du diabète.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
________________________________________________________________________________
Fig. 2.
Impact de l’élévation de la glycémie sur les voies métaboliques de toxicité cellulaire.
(Source : Brownlee M. The pathobiology of diabetic complications. Diabetes, 2005 ; 54 : 1615–25.)
________________________________________________________________________________
II Rétinopathie diabétique
La rétinopathie diabétique (RD) est essentiellement spécifique du diabète : la définition du diabète repose sur la mesure du risque de voir apparaître une rétinopathie. C’est une complication chronique de l’hyperglycémie : elle n’est jamais présente au début du diabète de type 1. Sa présence au moment du diagnostic du diabète de type 2 est le témoin du retard au diagnostic de diabète, marqué par des années d’hyperglycémie modérée et ignorée.
C’est la complication dont on peut éviter les conséquences cliniques graves (cécité) dans quasi tous les cas :
- examen ophtalmologique au diagnostic et surveillance annuelle ;
- optimisation du contrôle glycémique et lutte contre l’HTA ;
- traitement par laser (photocoagulation) si rétinopathie proliférante ou préproliférante sévère ;
- laser et/ou injections intravitréennes d’anti-VEGF dans la maculopathie œdémateuse.
A Épidémiologie
En France, selon l’étude ENTRED, 3,9 % des diabétiques déclarent la perte de la vision d’un œil, quelle que soit son origine ; de plus, 16,6 % des patients ont déclaré avoir bénéficié d’un traitement ophtalmologique par laser en raison d’une atteinte oculaire due au diabète ou à une autre pathologie. Le diabète reste pourtant la première cause de cécité acquise en France chez les moins de 55 ans (+++).
Les deux principaux facteurs de risque de RD sont la durée de l’hyperglycémie et l’intensité de celle-ci. Les facteurs de risque de rétinopathie sont présentés dans le tableau 1.
________________________________________________________________________________
Tableau 1.
Facteurs de risque de rétinopathie. (Source : CEEDMM, 2021.)
| Facteurs modifiables | Facteurs non modifiables | Situations à risque |
| – Contrôle glycémique (+++)
– Pression artérielle (++) – Tabac – Dyslipidémie – Protéinurie |
– Durée de diabète (+++)
– Âge – Prédisposition génétique |
– Puberté
– Grossesse – Amélioration rapide des glycémies après une longue période de mauvais contrôle |
________________________________________________________________________________
B Physiopathologie
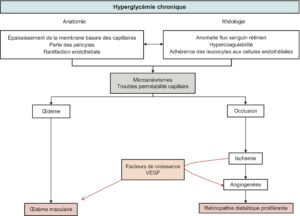
L’atteinte de la microcirculation rétinienne peut prendre deux formes différentes (fig. 3) :
- une voie va conduire à l’occlusion des capillaires rétiniens avec, en conséquence, une ischémie de la rétine et la sécrétion de facteurs proangiogéniques, au premier rang desquels le VEGF, avec développement anarchique de néovaisseaux ;
- une seconde voie, plus fréquemment dans le diabète de type 2, consiste en une altération de la perméabilité des capillaires, qui aboutit à un œdème de la rétine, dangereux lorsqu’il se situe au niveau de la macula, siège de la vision fine.
________________________________________________________________________________
Fig. 3.
Conséquences des anomalies vasculaires dans la physiopathologie de la rétinopathie.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
C Dépistage et surveillance
1 Dépistage
Le dépistage de la RD doit concerner tous les diabétiques. Un large consensus existe pour recommander une surveillance annuelle du fond d’œil de tout patient diabétique, de préférence par photographie du fond d’œil, à défaut par l’examen du fond d’œil au biomicroscope (lampe à fente) après dilatation pupillaire. Les examens peuvent être espacés tous les 2 ans en l’absence de rétinopathie diabétique, chez les patients non insulino-traités, équilibrés pour l’HbA1c et la pression artérielle.
Chez un diabétique de type 1, le début du diabète est connu avec précision. La RD ne survient en général pas avant 7 ans d’évolution pour un diabète apparu chez l’enfant, et pas avant 3 ans d’évolution pour un diabète découvert à l’âge adulte. Un examen du fond d’œil par photographies du fond d’œil sera cependant réalisé à la découverte du diabète — il servira d’examen de référence —, puis de façon annuelle. Chez les enfants, il n’est pas nécessaire que le premier examen ophtalmologique soit réalisé avant l’âge de 10 ans.
Chez un diabétique de type 2, le dépistage de la RD doit être réalisé dès la découverte du diabète. Une RD est présente dans 20 % des cas à la découverte du diabète de type 2.
2 Situations à risque d’évolution rapide
La surveillance doit être renforcée, quel que soit le stade de la rétinopathie, même minime, lorsqu’il existe un risque d’évolution rapide de la RD dans les situations suivantes :
- au cours de la puberté et de l’adolescence : c’est une période à haut risque d’évolution, particulièrement entre 16 et 20 ans, surtout si le diabète est instable ;
- lors de la grossesse,qui est une situation à risque d’aggravation de la rétinopathie, avec parfois des rétinopathies proliférantes florides nécessitant un traitement par laser en urgence. La surveillance est nécessaire avant la grossesse et une fois celle-ci débutée, tous les 3 mois.
D Diagnostic de gravité
Il existe un atlas des lésions, très complet et interactif, http://www.mrcophth.com/guidelinesindiabeticretinopathymanagement/diabeticretinopathyatlas.html. Certaines illustrations sont reprises ci-après (fig. 4). Les différents signes de rétinopathie permettent une classification selon une échelle de gravité (tableau 2).
On distingue souvent l’atteinte de la rétine périphérique responsable de lésion de type ischémique et celle de la rétine centrale (macula) responsable de lésions œdémateuses (fig. 5).
________________________________________________________________________________
Tableau 2.
Classification de la rétinopathie. (Source : CEEDMM, 2021.)
| Classification | Signes au fond d’œil | Risque de progression vers RDP à 5 ans | Rythme de surveillance | Traitement par laser | |
| Pas de rétinopathie | |||||
| RD non proliférante
|
RDNP minime | Microanévrismes | 15 % | 1–2 ans selon HbA1c et PA | Non |
| RDNP modérée | Exsudats, hémorragies | 33 % | Annuel | Non | |
| RDNP sévère (préproliférante) | Modifications veineuses, hémorragies étendues | 60 % | 3–4 mois | Oui | |
| RD proliférante
|
RDP minime | Néovaisseaux
|
|
3 mois
|
Oui |
| RDP modérée | Oui | ||||
| RDP sévère | 2–3 mois
|
Oui | |||
| RDP compliquée | Hémorragie intravitréenne
Décollement rétinien Glaucome néovasculaire |
Laser, chirurgie | |||
| Maculopathie diabétique
|
Exsudats | ||||
| Œdème maculaire non cystoïde | |||||
| Œdème maculaire cystoïde | |||||
| Maculopathie ischémique | |||||
________________________________________________________________________________
________________________________________________________________________________
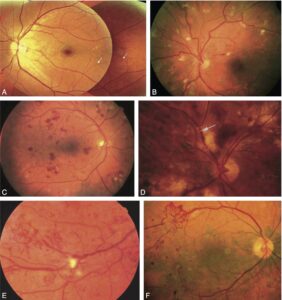
Fig. 4.
Signes de rétinopathie diabétique au fond d’œil.
A. Microanévrismes, hémorragies ponctuées. B. Nodules cotonneux. C. Hémorragies rétiniennes en taches. D. Irrégularité du calibre veineux (veines en chapelet). E. AMIR (anomalies microvasculaires intrarétiniennes). F. Néovascularisation.
(Source : Pr P. Massin, service d’ophtalmologie, hôpital Lariboisière, Paris.)
________________________________________________________________________________
________________________________________________________________________________
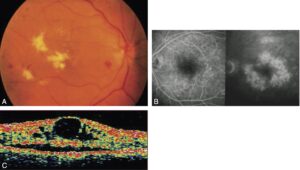
Fig. 5.
Œdème maculaire.
A. Rétinophotographie. B. Angiographie rétinienne. C. OCT.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Causes de baisse de l’acuité visuelle liées à la rétinopathie :
- développement anarchique de néovaisseaux pouvant conduire brutalement à :
- hémorragie « intravitréenne » (appelée également prérétinienne) ;
- décollement de rétine (décollement tractionnel) ;
- glaucome néovasculaire ;
- œdème maculaire responsable d’une maculopathie diabétique (baisse de l’acuité visuelle lente, à la différence des causes ci-dessus).
E Traitement
Il existe plusieurs modalités de traitement.
1 Équilibre glycémique et tensionnel (+++)
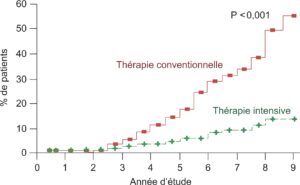
La figure 6 illustre le bénéfice du bon contrôle glycémique d’après le DCCT, essai randomisé qui compare, sur une période de 9 ans, l’incidence cumulée de l’aggravation de la rétinopathie chez des diabétiques de type 1, indemnes de rétinopathie initialement, avec un bon contrôle (groupe intensif, environ 7 % d’HbA1c) ou un mauvais contrôle (groupe dit conventionnel, HbA1c de 9 %).
________________________________________________________________________________
Fig. 6.
Incidence cumulée de la rétinopathie diabétique en fonction du contrôle glycémique (d’après le DCCT, Diabetes Control and Complications Trial Research Group).
Les deux groupes de contrôle glycémique sont : 1) un groupe intensif avec environ 7 % d’HbA1c ; 2) un groupe dit conventionnel avec 9 % d’HbA1c.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
2 Panphotocoagulation rétinienne
Le laser réduit de plus de 50 % le risque de cécité et entraîne une régression de la néovascularisation dans 70 à 90 % des cas.
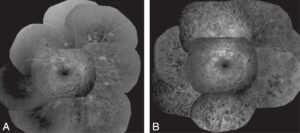
La panphotocoagulation rétinienne est réalisée en ambulatoire, progressivement. Elle fixe la rétine et fait régresser la néovascularisation en périphérie des zones ischémiques (fig. 7).
________________________________________________________________________________
Fig. 7.
Panphotocoagulation rétinienne.
A. Rétinopathie avant photocoagulation. B. Après laser.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Dans les formes sévères, florides, ou lorsque les saignements persistent, les traitements par injection intraoculaire d’inhibiteurs du VEGF ont connu un développement rapide et sont associés à une amélioration du pronostic visuel.
L’œdème maculaire pose des problèmes thérapeutiques mal résolus :
- l’équilibre de la pression artérielle est essentiel ;
- les traitements par anti-VEGF sont bénéfiques chez 50 % des patients, mais leur effet est transitoire, nécessitant la répétition des injections ;
- les injections intravitréennes de corticoïdes ont vu leur champ d’application se réduire avec la mise en place de protocole de traitement par anti-VEGF.
________________________________________________________________________________
Ce que le patient doit connaître
Rétinopathie
Le diabète est la première cause de cécité dans les pays industrialisés avant l’âge de 50 ans.
Rôle péjoratif :
- du mauvais équilibre glycémique ;
- de l’ancienneté du diabète ;
- de l’existence d’une HTA mal contrôlée.
Le diabétique doit connaître les points suivants :
- un examen ophtalmologique doit être effectué tous les ans ou tous les 2 ans, dès le diagnostic du diabète ;
- une acuité visuelle normale n’élimine pas une rétinopathie.
Par ailleurs, il doit savoir que les signes suivants, baisse de l’acuité visuelle, troubles de la vision des couleurs, déformations des images et sensation de voile, sont des signes beaucoup trop tardifs.
Les troubles de la réfraction sont fréquents quand la glycémie varie rapidement de façon importante et ne doivent pas conduire à la prescription intempestive de nouvelles lunettes.
________________________________________________________________________________
F Autres complications oculaires
Les autres complications oculaires rencontrées peuvent être :
- la cataracte, plus fréquente et plus précoce chez les diabétiques (+++) ;
- les paralysies oculomotrices, qui peuvent concerner les nerfs oculomoteurs III, IV ou VI, régressant spontanément en quelques mois ; il s’agit d’une manifestation de mononeuropathie diabétique.
III Néphropathie diabétique
A Épidémiologie
Le diabète est la première cause d’insuffisance rénale terminale en Europe, à un niveau voisin de l’hypertension artérielle (12 à 30 %). Aux États-Unis, il représente plus de la moitié des cas de dialyse. Cette proportion de patients diabétiques dans les centres de dialyse va croissant, du fait de l’augmentation de la prévalence du diabète de type 2 et de l’espérance de vie prolongée des diabétiques grâce à une meilleure prévention cardiovasculaire primaire et secondaire.
Les diabétiques de type 2 représentent environ trois quarts des diabétiques dialysés. En 2013, 4 256 patients avec diabète traité pharmacologiquement ont démarré un traitement de suppléance rénale (9 fois plus de risque que pour les individus sans diabète).
Si le risque d’insuffisance rénale terminale est logiquement d’autant plus élevé que les signes d’atteinte rénale sont avancés, le risque cardiovasculaire l’est aussi : × 10 chez les diabétiques de type 1 ; × 3 à 4 chez les diabétiques de type 2. Autrement dit, les signes de néphropathie sont des marqueurs de risque cardiovasculaire. Du fait de ses autres facteurs de risque (âge, hypertension, etc.), un patient avec diabète de type 2 et néphropathie a plus de risque de mourir de cause cardiovasculaire que d’atteindre la dialyse : il est donc sous une double menace. Heureusement, les thérapeutiques protectrices se recouvrent.
Facteurs de risque de néphropathie :
- ancienneté du diabète (dans le diabète de type 1, jamais avant 10 ans d’évolution, rarement avant 15 ans), début du diabète dans l’enfance ;
- mauvais équilibre glycémique (et tensionnel) chronique ;
- cas familiaux d’insuffisance rénale, surtout si liée au diabète ;
- origine : africaine subsaharienne, Antilles, île Maurice, Inde, Madagascar et Réunion, îles du Pacifique, Amérique du Sud ;
- tout signe d’insulinorésistance (obésité abdominale, hypertriglycéridémie, forts besoins en insuline, etc.) ;
- tabagisme.
B Physiopathologie
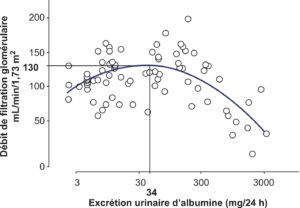
La néphropathie diabétique est une atteinte glomérulaire, s’accompagnant d’une élévation de la pression intraglomérulaire, secondaire à la souffrance endothéliale : on constate un déséquilibre du tonus des artères afférentes et efférentes, et les glomérules sont moins à l’abri de la pression artérielle systémique. Sous l’augmentation de la pression intraglomérulaire, les glomérules se dilatent — les reins des diabétiques sont gros et filtrent plus à court terme : les diabétiques ont initialement une hyperfiltration. Mais, progressivement, les qualités fonctionnelles du filtre glomérulaire s’altèrent : il laisse passer de plus en plus d’albumine, elle-même toxique pour les segments distaux du néphron. Les glomérules se sclérosent, la filtration glomérulaire, jusque-là élevée, s’abaisse. La figure 8 illustre le point d’inflexion entre l’augmentation de l’excrétion urinaire d’albumine et l’élévation, puis le déclin de la filtration glomérulaire : ce point d’inflexion constitue le seuil définissant l’albuminurie pathologique, la « microalbuminurie ».
________________________________________________________________________________
Fig. 8.
Relation observée entre l’excrétion urinaire d’albumine (moyenne de trois recueils consécutifs des urines de 24 heures) et le taux de filtration glomérulaire (technique de la mesure de la clairance du 51Cr-EDTA).
Observation de 84 patients diabétiques de type 1 consécutifs, sans traitement antihypertenseur : r = 0,576, p = 0,0001. Les coordonnées du sommet du modèle parabolique sont : 34 mg/24 heures et 130 ml/min/1,73 m2.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Lorsque l’excrétion urinaire d’albumine atteint des niveaux détectables par de simples bandelettes urinaires, on parle de macroalbuminurie ou protéinurie.
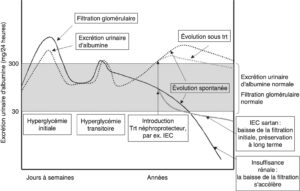
La figure 9 décrit l’évolution de l’excrétion urinaire d’albumine et de la filtration glomérulaire dans le diabète de type 1.
________________________________________________________________________________
Fig. 9.
Histoire naturelle : évolution de l’excrétion urinaire d’albumine et de la filtration glomérulaire dans le diabète de type 1, spontanément ou sous l’influence de traitements néphroprotecteurs.
La filtration glomérulaire et l’excrétion d’albumine varient longtemps parallèlement, jusqu’au stade de protéinurie où le déclin de la fonction rénale s’accélère.
trt, traitement ; IEC, inhibiteurs de l’enzyme de conversion.
(Source : Mogensen C et al. The stages in diabetic renal disease. With emphasis on the stage of incipient diabetic nephropathy. Diabetes 1983 ; 32 : 64–78.)
________________________________________________________________________________
C Dépistage (+++)
Recommandations officielles concernant l’insuffisance rénale dans le diabète (HAS 2014, Parcours de soins du diabète de type 2 ; HAS 2011, Évaluation du rapport albuminurie/créatininurie ; ANAES 2002, Diagnostic de l’insuffisance rénale chronique chez l’adulte) : il convient de :
- pratiquer au moins une fois par an chez le diabétique de type 2 (et chez le diabétique de type 1 au-delà de la cinquième année), la recherche d’une protéinurie par la bandelette urinaire standard ; ce test a aussi pour but de rechercher une hématurie et/ou une infection urinaire, qui demandent des explorations spécifiques et qui peuvent fausser l’interprétation de l’albuminurie ;
- détecter l’excrétion urinaire d’albumine par le rapport albuminurie/créatininurie sur échantillon d’urine recueilli à tout moment de la journée plutôt que le recueil des urines des 24 heures ; le résultat sera considéré comme pathologique (ce qui est mesuré est l’albuminurie ; microalbuminurie et macroalbuminurie sont des résultats pathologiques) s’il est confirmé à deux reprises (un dépistage, deux confirmations) ;
- vérifier à 6 mois que la microalbuminurie ou la protéinurie régresse ou se stabilise (HAS, 2011).
Ces recommandations s’appliquent aux sujets diabétiques quel que soit le type.
Il faut garder à l’esprit les conditions favorisant un résultat faussement positif de la recherche de microalbuminurie (tableau 3).
________________________________________________________________________________
Tableau 3.
Conditions physiologiques ou pathologiques augmentant le risque de faux positifs du dépistage de la microalbuminurie. (Source : CEEDMM, 2021.)
| – Orthostatisme prolongé
– Activité physique intense – Variation marquée de la pression artérielle – Tabagisme – Fièvre – Poussée d’insuffisance cardiaque – Hyperglycémie marquée – Infection urinaire (faire une bandelette urinaire) |
________________________________________________________________________________
La recherche de microalbuminurie peut aussi — ce n’est pas la recommandation de la HAS — être effectuée sur les urines des 24 heures ou sur un échantillon sans mesure de la créatininurie. Les différents seuils définissant les anomalies de l’excrétion urinaire d’albumine sont rappelés dans le tableau 4.
________________________________________________________________________________
Tableau 4.
Seuils pathologiques de définition de la microalbuminurie et de la macroalbuminurie.
Ces seuils sont équivalents à ceux des recommandations internationales de néphrologie (KDIGO) qui, cependant, n’utilisent plus les termes micro-/macroalbuminurie mais albumine urinaire « normale », « élevée » ou « très élevée ». (Source : CEEDMM, 2021.)
| Normale (albuminurie physiologique) | Micro-albuminurie | Macro-albuminurie ou protéinurie | ||
| HAS (2011) | Sur échantillon : [Albuminurie/
Créatininurie] |
< 3 mg/mmol | 3–30 mg/mmol | > 30 mg/mmol |
| Non recommandé par HAS
|
Sur échantillon : [Albuminurie] | < 20 mg/l | 20–200 mg/l | > 200 mg/l |
| Sur urines des 24 heures | < 30 mg/24 h | 30–300 mg/24 h | > 300 mg/24 h | |
________________________________________________________________________________
D Diagnostic
1 Signes cliniques
Les signes cliniques sont tardifs : HTA habituelle quand la protéinurie est établie, œdèmes accompagnant la protéinurie quand elle est abondante et quand l’insuffisance rénale s’installe (cf. Items 261 et 258).
2 Signes associés
Une rétinopathie est en général présente au diagnostic de néphropathie, surtout chez le diabétique de type 1, mais cela n’est pas constant.
Chez le diabétique de type 2 qui cumule souvent les facteurs de risque, on doit facilement suspecter une sténose des artères rénales (10 à 50 % dans le type 2, selon les séries), qui peut se manifester par une HTA résistante aux traitements et/ou une dégradation rapide de la fonction rénale, spontanément ou lors de l’introduction de bloqueurs du système rénine-angiotensine.
L’hyperkaliémie est plus fréquente chez les diabétiques, et ce à des stades plus précoces d’insuffisance rénale qu’en l’absence de diabète. Elle est favorisée par les IEC et les sartans préconisés dans la néphropathie. Elle justifie des mesures de vigilance (attention à la déshydratation), des mesures diététiques et une surveillance régulière adaptée. Parfois des chélateurs du potassium sont nécessaires.
3 Signes histologiques
Le diagnostic de la néphropathie diabétique est histologique. Cependant, la ponction-biopsie rénale est rarement pratiquée : en présence d’une rétinopathie affirmant l’exposition prolongée à l’hyperglycémie, d’une excrétion urinaire d’albumine augmentée de façon répétée et progressivement croissante, on retient le diagnostic de néphropathie diabétique (stricto sensu à partir du stade de macroalbuminurie ; avant, la néphropathie est dite incipiens ou silencieuse).
La ponction-biopsie rénale sera réservée aux situations atypiques :
- absence de rétinopathie associée ;
- apparition précoce (moins de 10 ans après le diagnostic de diabète) de la néphropathie chez un diabétique de type 1 ;
- évolution rapide vers l’aggravation, vers l’insuffisance rénale ;
- hématurie ou HTA sévère (rechercher une pathologie rénovasculaire) ou protéinurie non sélective ou œdèmes importants à un stade précoce ;
- signes extra-rénaux (cutanés, pulmonaires, etc.) évoquant une autre cause : lupus, sarcoïdose, etc.
La démarche diagnostique est alors celle d’une glomérulopathie (cf. « Néphropathies glomérulaires » de l’Item 261).
E Classification
La classification des néphropathies diabétiques est représentée dans le tableau 5.
________________________________________________________________________________
Tableau 5.
Classification des néphropathies diabétiques.
⁎ Attention : la ponction-biopsie rénale n’est pas systématique. (Source : CEEDMM, 2021.)
| Stade 1 | Stade 2 | Stade 3 | Stade 4 | Stade 5 | ||
| Histoire naturelle
|
Caractéristiques | Hypertrophie rénale, hyperfiltration glomérulaire | Phase silencieuse | Néphropathie incipiens | Néphropathie | Insuffisance rénale |
| Années après le diagnostic (schématique) | 1 an | 2–6 ans | 7–15 ans | 15–20 ans | 20–30 ans | |
| Albuminurie | Normale | Normale | Microalbuminurie (30–300 mg/24 heures ou 20–200 mg/l) | Protéinurie (albuminurie > 300 mg/24 heures ou 200 mg/l) | Protéinurie massive à faible lorsque la fonction rénale est profondément altérée | |
| Pression artérielle | Normale | Normale | Peut être discrètement augmentée, perte de la baisse nocturne | Souvent élevée | Souvent élevée | |
| Filtration glomérulaire | Élevée (de l’ordre de + 20 %) | Élevée à normale | Normale ou discrètement abaissée | Baisse de 10 ml/min/an en l’absence de traitement | Basse à effondrée | |
| Histologie* | Hypertrophie glomérulaire sans signes en microscopie optique | Début d’expansion mésangiale diffuse | Poursuite de l’expansion mésangiale, épaississement de la membrane basale, constitution de nodules de sclérose, hyalinose artériolaire | Sclérose puis destruction glomérulaire et interstitielle, | ||
________________________________________________________________________________
F Traitement (+++)
1 Prévention primaire
La prévention primaire (éviter l’apparition d’une albuminurie excessive et d’un déclin de la fonction rénale) repose sur l’équilibre glycémique et la maîtrise des facteurs de risque associés, en particulier de l’HTA et du tabagisme (cf. Item 222 et Item 224).
2 Prévention dès le stade de microalbuminurie
L’essentiel repose sur :
- le contrôle de la glycémie : HbA1c < 7 % et plus bas si possible sans risque d’hypoglycémie (HAS, 2013) ;
- le contrôle de la pression artérielle : < 140/85 mmHg (HAS, 2014) ; le recours à l’automesure et à l’enregistrement ambulatoire de la pression artérielle est recommandé ;
- l’utilisation d’inhibiteurs de l’enzyme de conversion(IEC) ou d’antagonistes des récepteurs de type 1 de l’angiotensine II (sartans) qui ralentissent la progression de la néphropathie diabétique. Il faut souligner que l’association IEC + sartan a un rapport bénéfices/risques défavorable ;
- la prise en charge de tous les facteurs de risque associés, dont le tabac. La prescription de statine repose sur l’évaluation du risque cardiovasculaire global mais, chez les diabétiques avec micro- ou macroalbuminurie, elles sont souvent indiquées (HAS, 2014) ;
- le régime hypoprotidique : 0,8 g/kg par jour ;
- des apports en sel modérés, de l’ordre de 6 g par jour.
3 Au stade de macroalbuminurie
La priorité absolue est le contrôle tensionnel : objectif général < 140/85 mmHg. On associe souvent aux bloqueurs du système rénine-angiotensine (IEC ou sartan, cf. supra) un diurétique thiazidique et également un inhibiteur calcique.
Un objectif important est de ramener le débit de protéinurie en dessous de 0,5 g par 24 heures.
Vérifier à 6 mois que la microalbuminurie ou la protéinurie régresse ou se stabilise (HAS, 2013).
4 Au stade d’insuffisance rénale
Les mêmes principes s’appliquent, selon les recommandations de la HAS (2013) :
- l’objectif d’HbA1c est < 8 % si la filtration estimée est < 30 ml/min/1,73 m2 ;
- pour un DFG entre 30 et 60 ml/min/1,73 m2, adapter les posologies, en particulier pour la metformine qui doit être réduite à demi-dose (elle n’a PAS de toxicité rénale, mais est à élimination rénale) et porter une attention particulière aux interactions médicamenteuses (adapté de HAS, 2013) ;
- à partir du stade 4 (DFG < 30 ml/min/1,73 m2), les seules classes antidiabétiques autorisées (AMM) sont l’insuline, le répaglinide, les inhibiteurs des α-glucosidases, les inhibiteurs de la DPP-4 à posologie adaptée (HAS, 2013) et certains agonistes du agonistes du récepteur du GLP-1. Les hypoglycémies sont plus fréquentes quand le stade est 3B ou plus sévère (sous insuline ou sulfamide) ;
- surveillance de l’équilibre glycémique par l’HbA1c : l’HbA1c est souvent un marqueur moins fiable en cas d’IRC ; elle est en particulier faussement élevée en cas d’acidose, faussement diminuée en cas d’hémolyse, de carence martiale (HAS, 2012) ;
- l’objectif cible de la pression artérielle systolique est ramené à moins de 130 mmHg pour prévenir la progression des complications (HAS, 2013), toujours dans la mesure de la tolérance d’un objectif aussi bas.
Il faut aussi prendre en charge les anomalies phosphocalciques, l’anémie arégénérative (traitement par érythropoïétine) et la préparation de la suppléance rénale qui, en pratique, est nécessaire à un niveau moyen de filtration glomérulaire supérieur chez les diabétiques (vaccination VHB, fistule ou, le plus souvent possible, dialyse péritonéale) : référer au néphrologue. La transplantation est à envisager systématiquement.
________________________________________________________________________________
À tous les stades, mais d’autant plus que la filtration est abaissée, il faut éviter les situations à risque d’accélération de la progression de la néphropathie :
- éviter les AINS ; si cure courte d’AINS nécessaire, ne pas associer aux IEC/sartan et prévenir toute déshydratation ;
- limiter au strict nécessaire les injections de produits de contraste iodés, hydrater abondamment, éventuellement par voie IV si insuffisance rénale.
________________________________________________________________________________
________________________________________________________________________________
Recours au néphrologue
Le recours au néphrologue est conseillé dès qu’il existe un doute diagnostique sur l’origine diabétique de l’atteinte rénale, dès que le DFG est inférieur à 45 ml/min/1,73 m2 (stade 3B d’insuffisance rénale chronique), indispensable en cas d’apparition brutale d’une protéinurie chez un patient qui en était indemne jusque-là (HAS, 2013).
________________________________________________________________________________
________________________________________________________________________________
IEC et sartans
Se méfier d’une sténose des artères rénales : doser kaliémie et créatininémie dans la semaine qui suit l’introduction. Une baisse limitée (de l’ordre de 10 % de la filtration glomérulaire estimée) est cependant un effet normal de ces classes thérapeutiques.
L’introduction des IEC et sartans peut être à posologie croissante, mais la dose à atteindre dans la limite de la tolérance est la pleine dose (pas d’efficacité sur les critères durs dans les essais des « petites doses »).
________________________________________________________________________________
________________________________________________________________________________
Ce que le patient doit connaître
Néphropathie
Le diabète est la première cause d’insuffisance rénale dans les pays industrialisés.
Rôle péjoratif :
- du mauvais équilibre glycémique ;
- de l’ancienneté du diabète ;
- de l’existence d’une HTA ;
- du tabagisme.
Le diabétique doit savoir :
- qu’un examen des urines doit être effectué tous les ans, dès le diagnostic du diabète, et que si son médecin ne le prescrit pas, il doit le lui rappeler ;
- que l’atteinte rénale du diabète ne fait pas mal et qu’on urine normalement ;
- qu’il n’y a pas de signe d’alerte, sauf l’analyse des urines.
________________________________________________________________________________
G Autres complications rénales, infections urinaires
Leur fréquence est multipliée par 3 à 4 ; 90 % des infections urinaires basses sont asymptomatiques.
Dépistage : sur signes d’appel principalement. La bandelette urinaire peut avoir un intérêt une fois par an.
Conséquences :
- le risque est essentiellement la contamination du haut appareil urinaire, avec :
- la pyélonéphrite, elle-même compliquée chez le diabétique ;
- la nécrose papillaire (à soupçonner si l’évolution sous antibiotiques n’est pas favorable ; aspect échographique évocateur) ;
- risque à moyen terme d’aggravation d’une néphropathie glomérulaire débutante ou avancée.
Traitement :
- oui, selon les mêmes modalités que chez les autres patients, si l’infection urinaire est symptomatique ;
- si l’infection est asymptomatique, le dogme du traitement systématique chez le diabétique est remis en question, la stérilisation des urines étant de courte durée et la fréquence ultérieure des infections, symptomatiques cette fois, n’étant pas modifiée. Il n’y a donc pas de consensus actuel.
Les récidives sont fréquentes : 70 % des cas.
IV Neuropathie diabétique
On distingue :
- la polynévrite axonale ascendante, qui atteint les fibres nerveuses en fonction de leur longueur, progressant des extrémités vers les racines des membres. Elle atteint bien plus communément les sensibilités (tous modes) que la motricité ;
- la neuropathie autonome, qui touche les fibres neurovégétatives ;
- les atteintes monoradiculaires, touchant parfois plusieurs racines simultanément, réalisant alors une multinévrite.
Leur expression clinique et leur délai d’apparition sont différents.
A Épidémiologie
La neuropathie autonome diabétique est une complication plutôt tardive. Il est rare qu’elle précède la rétinopathie dans le diabète de type 1.
Mais, la neuropathie périphérique est une complication multifactorielle (glycémie, lipides, alcool…) et donc potentiellement précoce dans le diabète de type 2.
Sa prévalence est très variable selon les études et croît avec la durée du diabète, de 10 à 60 %. On peut retenir qu’elle concerne 50 % des patients diabétiques après 20 ans d’évolution de la maladie.
À exposition identique à l’hyperglycémie, la présence et l’expression de la neuropathie périphérique sont très variables. Des facteurs favorisants ont été identifiés, parmi lesquels :
- une grande taille (sans doute en raison de la plus grande longueur des fibres) ;
- le tabagisme ;
- l’âge (la fréquence est très grande au-delà de 65 ans) ;
- la présence d’une artériopathie des membres inférieurs ;
- des carences nutritionnelles, vitaminiques ;
- l’alcool ;
- l’insuffisance rénale.
B Physiopathologie
L’hyperglycémie chronique est le déterminant du développement de la neuropathie. Elle est la conséquence d’une atteinte métabolique qui ne semble pas se distinguer histologiquement d’autres étiologies métaboliques, telles que l’alcoolisme ou l’urémie pour la localisation périphérique. S’y associe une atteinte vasculaire, par oblitération du fin réseau des vasa nervorum qui est intimement mêlé aux différentes fibres nerveuses présentes dans le nerf périphérique.
C Dépistage
Le dépistage de la neuropathie périphérique sensorimotrice repose uniquement sur l’examen clinique et l’interrogatoire. Il n’y a pas de place pour l’électromyogramme, sauf en cas d’atypie. Il faut rechercher à l’examen les déficits sensitifs et à l’interrogatoire les caractéristiques typiques de la douleur neuropathique.
Le dépistage de la neuropathie autonome repose sur l’examen clinique et l’interrogatoire ; le diagnostic doit être confirmé par des examens complémentaires.
D’autres atteintes neurologiques peuvent se voir chez le patient diabétique, mais elles sont plus rares.
D Classification
La classification des neuropathies diabétiques est représentée dans le tableau 6.
________________________________________________________________________________
Tableau 6.
Classification de la neuropathie diabétique. (Source : CEEDMM, 2021.)
| Neuropathie sensorimotrice | – Polynévrite sensitive distale symétrique = polynévrite
– Mononévrite (par exemple, paralysie oculomotrice) – Polyradiculopathie thoracique |
| Neuropathie autonome | – Neuropathie cardiaque autonome
– Neuropathie vasomotrice – Dysrégulation de la sudation, de la commande des glandes sébacées, en général par atteinte des contingents sympathiques et parasympathiques au cours de la polynévrite. – Neuropathie autonome gastro-intestinale • gastroparésie • alternance diarrhée/constipation • incontinence fécale – Neuropathie autonome génito-urinaire • dysfonction vésicale, le plus souvent une vessie rétentionnelle, dilatée avec mictions par rengorgement, plus rarement par une vessie intolérante au remplissage avec mictions fréquentes • éjaculation rétrograde, dysfonction sexuelle, troubles de l’érection |
________________________________________________________________________________
E Diagnostic, présentation clinique
Plusieurs présentations sont possibles et peuvent coexister. Quoi qu’il en soit, la neuropathie débutante est souvent silencieuse et doit être recherchée activement. En particulier, l’examen des pieds est aussi important et systématique en consultation de diabétologie que l’auscultation cardiaque en cardiologie (+++).
________________________________________________________________________________
Toute consultation chez un patient diabétique doit comporter l’examen des pieds.
________________________________________________________________________________
1 Neuropathie sensorimotrice
Les fibres les plus longues sont altérées les premières : les symptômes ont une topographie ascendante avec le temps, dite en « chaussettes » — et beaucoup plus tardivement ensuite au niveau des membres supérieurs, en « gants » ; l’atteinte des mains s’observe lorsque l’atteinte des membres inférieurs est au-dessus des genoux.
Il existe deux types de fibres :
- les fibres les plus petites concernent les sensations thermiques, algiques et du toucher fin (tact épicritique) ; la souffrance des petites fibres peut se traduire aussi par des sensations douloureuses (impression de pieds glacés ou brûlants, décharges électriques, allodynie assez caractéristique : c’est la perception comme douloureux de stimulus qui ne le sont pas, par exemple, souvent rapportée par les patients, les sensations douloureuses du poids des draps sur les pieds…) ;
- les fibres les plus grosses concernent les sensations de position des articulations (proprioception), la sensibilité vibratoire, la sensibilité à la pression explorée par le monofilament, éventuellement la force motrice.
L’examen clef du diagnostic est l’examen clinique pour la perte de sensibilité, qui n’est pas consciente, et l’interrogatoire pour les sensations douloureuses.
L’électromyogramme (EMG) est inutile le plus souvent et ne sera prescrit que lorsqu’il existe un doute quant à l’étiologie des signes neurologiques. Il n’explore que les grosses fibres et pourra donc être normal alors qu’il existe une authentique neuropathie des petites fibres.
Polynévrite symétrique distale
Cette forme de neuropathie diabétique, la plus fréquente, concerne plus de 40 % des diabétiques de plus de 25 ans d’évolution. Elle est chronique et progressive ; la régression est rare, même après normalisation glycémique prolongée. Elle se manifeste par :
- une hypoesthésie à la pression et/ou au tact et/ou thermique et/ou proprioceptive, totalement ignorée du patient, qui se recherche à l’examen clinique des pieds et des jambes ;
- parfois associée à des paresthésies distales, initialement aux orteils et plantes des pieds puis plus proximales (fourmillements, sensation de cuisson, de peau cartonnée, de douleurs « électriques », de crampes) ;
- parfois des douleurs, pouvant être atroces, sensation d’« arc électrique », sensation d’écrasement, de brûlure ; ces sensations douloureuses peuvent cohabiter avec un examen clinique normal mais doivent faire évoquer une neuropathie douloureuse des petites fibres ; le diagnostic est confirmé par le questionnaire DN4 (fig. 10) ;
- des réflexes achilléens abolis, ainsi que plus tardivement les rotuliens ;
- tardivement, des déformations de la voûte plantaire qui se creuse, déplacement antérieur des coussinets normalement situés sous les têtes des métatarsiens, des orteils en griffes, le maintien de positions vicieuses, l’acquisition de points d’appui anormaux.
Une complication de la neuropathie est la neuroarthropathie, qui se manifeste par des microfractures passant inaperçues et qui, non traitées, peuvent conduire à un effondrement de la voûte plantaire avec une dislocation des os du tarse, dénommé le pied « cubique » de Charcot.
________________________________________________________________________________
Fig. 10.
Questionnaire DN4.
Mode d’emploi : Lorsque le praticien suspecte une douleur neuropathique, le questionnaire DN4 est utile comme outil de diagnostic.
(Source : Bouhassira D. et al. Development and validation of the Neuropathic Pain Symptom Inventory. Pain, 2004 ; 108 (3) : 248–57.)

________________________________________________________________________________
Autres formes de neuropathies périphériques
Les autres formes sont plus rares (5 à 15 %). Leur début est brutal, faisant suspecter une pathologie ischémique, mais parfois il s’agit seulement de la compression radiculaire ou tronculaire d’un nerf « fragilisé par le diabète ». Ces mononeuropathies se traduisent essentiellement par des signes moteurs déficitaires, des douleurs évocatrices par leur exacerbation nocturne.
Une atteinte proximale est également possible, sous la forme d’une radiculopathie touchant L2, L3 et parfois L4, avec une cruralgie suivie d’une fatigabilité et d’une amyotrophie douloureuse.
La polyradiculopathie thoracique se présente comme des douleurs abdominales correspondant à un ou plusieurs niveaux entre T4 et T12.
La mononévrite est une complication rare du diabète. Manifestée sur un mode aigu, elle est asymétrique par définition. Aucun nerf n’est théoriquement épargné, mais les situations rencontrées généralement sont les paralysies des nerfs crâniens, notamment la paralysie du VI, voire du III, du IV ou du facial, d’un côté ; elles surviennent plutôt chez des sujets âgés.
Les membres supérieurs sont moins souvent touchés. Il s’agit alors souvent d’une neuropathie compressive, telle une compression du médian dans le canal carpien. Les membres inférieurs peuvent être touchés sur le mode sensitif (cruralgies intenses).
2 Neuropathie autonome diabétique
C’est une complication d’un diabète ancien et mal équilibré, où les nerfs vague et du système sympathique ont été lésés. La régression est rare, même après normalisation glycémique prolongée.
Neuropathie autonome cardiovasculaire
Elle se manifeste par l’un ou l’autre des signes suivants :
- une tachycardie sinusale quasi permanente, dont la fréquence, de l’ordre de 110/min, ne varie que très peu pendant l’effort ; elle participe à l’intolérance à l’effort ;
- rarement, une bradycardie permanente ;
- un allongement du QT à l’ECG, participant au surrisque de mort subite chez les diabétiques.
Elle est peut-être la cause de l’absence de douleur angineuse à l’occasion d’une ischémie myocardique : l’ischémie silencieuse — en réalité l’ischémie est bien plus souvent silencieuse pour d’autres raisons (absence d’activité physique, par exemple) qu’à cause d’une neuropathie autonome.
Neuropathie autonome vasomotrice
Elle se manifeste par les signes suivants :
- hypotension orthostatique, sans accélération du pouls. L’hypotension orthostatique se définit par une baisse de plus de 20 mmHg de la PA systolique ou 10 mmHg de la diastolique 3 minutes après le lever chez un patient au préalable allongé depuis plus de 5 minutes (consensus 2017) ; elle peut aussi être iatrogène chez des patients souvent polymédicamentés (antihypertenseurs) ;
- troubles de la sudation.
Neuropathie digestive gastro-intestinale
Elle peut se manifester par les signes suivants :
- gastroparésie fréquente : satiété rapide, pesanteur abdominale, régurgitations ou vomissements alimentaires ; elle est cause d’instabilité glycémique (+++) ;
- diarrhée d’allure banale ou diarrhée motrice, mais toujours d’évolution capricieuse ;
- constipation, alternant ou non avec la diarrhée ;
- incontinence fécale, rare, à la fois due aux troubles du transit cités et à une baisse du tonus sphinctérien.
Neuropathie vésicale
Elle est caractérisée par un défaut de perception de la plénitude vésicale et par une hypoactivité du détrusor, mais elle est aussi favorisée par la polyurie de l’hyperglycémie. Parfois c’est l’inverse qui est observé : vessie intolérante au remplissage, cause de pollakiurie. De nombreux médicaments peuvent aggraver la symptomatologie.
Dysfonction érectile
La dysfonction érectile est caractérisée par une difficulté à initier l’érection, à la maintenir, également par une anéjaculation ou une éjaculation rétrograde, ces deux derniers symptômes bien plus caractéristiques de la neuropathie que la dysrérection, qui admet de multiples causes, au premier rang desquelles des causes psychogènes. Il peut s’agir de l’un des premiers signes de neuropathie autonome, à rechercher à l’interrogatoire systématiquement.
3 Examens diagnostiques utiles
Le seul examen impératif est clinique :
- interrogatoire (signes d’hypotension orthostatique, diarrhée, etc.) ;
- inspection des pieds ; recherche des réflexes ostéotendineux, abolis au même niveau que la symptomatologie sensitive (par exemple, les achilléens sont abolis dans la polynévrite en « chaussettes ») ;
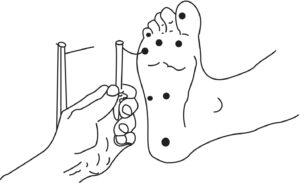
- un test global simple et standardisé est validé, le monofilament : il s’agit d’un fil de nylon rigide (10 G) que l’on applique en appuyant doucement jusqu’à ce qu’il se plie sur la face plantaire des pieds (Fig. 11). Ce test est plus pronostique du risque de plaie du pied que diagnostique de la neuropathie. On cote le résultat en fonction du nombre d’applications détectées. Mais ce test ne détecte qu’une atteinte des grosses fibres. Il laisse passer 30 % des neuropathies périphériques. En cas de doute, il faut rechercher d’autres atteintes sensitives et des douleurs typiques à l’interrogatoire (DN4) ;
- test de la sensibilité épicritique (pique-touche, sans blesser les pieds, etc.), thermoalgique, vibratoire (diapason), proprioceptive.
De plus, un ECG est réalisé annuellement au minimum chez tout diabétique.
________________________________________________________________________________
Fig. 11.
Examen des pieds au moyen du monofilament.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Les examens complémentaires éventuels sont :
- l’EMG, seulement en cas d’atypie, indication relevant du spécialiste. En effet, après 10 à 15 ans de diabète, l’EMG est anormal chez tout diabétique et il a donc une valeur diagnostique médiocre. Inversement, il peut être normal en cas d’atteinte isolée des petites fibres, en particulier de neuropathie douloureuse. Les anomalies typiques sont une axonopathie distale démyélinisante ; les VCN (vitesse de conduction nerveuse) et l’amplitude des potentiels d’action des nerfs sensitifs puis moteurs sont réduites ;
- l’étude de la variation du rythme cardiaque au cours de manœuvre telle qu’un effort ou certains tests dans la neuropathie autonome cardiaque ;
- la gastroparésie, parfois évidente à la fibroscopie en raison de la persistance du bol alimentaire, peut être authentifiée par une scintigraphie d’un bol alimentaire marqué dont le transit est ralenti (images itératives montrant une stagnation du marqueur radioactif dans la poche gastrique) ; examen long et coûteux pratiqué seulement dans certains centres, mais nécessaire avant la mise en route de traitements spécifiques ;
- la mesure par échographie du résidu vésical postmictionnel, un bilan urodynamique dans la neuropathie vésicale.
4 Tests permettant de rechercher une dénervation cardiaque parasympathique
- Variations de la fréquence cardiaque lors de la respiration profonde.
- Épreuve de Valsalva.
- Variations de la fréquence cardiaque lors du passage de la position couchée à la position debout.
5 Diagnostic différentiel de la neuropathie chronique sensitive
Il faut toujours analyser la situation avec précaution et se poser la question d’une autre étiologie que le diabète. En effet, les traitements spécifiques existent parfois et peuvent transformer le tableau clinique.
F Traitement
Le seul traitement réellement efficace à ce jour est préventif : l’équilibre glycémique. Il convient également d’éviter les autres facteurs favorisants, tels que :
- l’alcool ;
- le tabac ;
- l’insuffisance rénale ;
- les carences en vitamines du groupe B (en particulier la carence en vitamine B12chez les patients traités au long cours par metformine ; le risque est dépendant de la dose totale cumulée) ;
- les effets secondaires de certains médicaments.
Une fois la neuropathie installée, on ne peut guère plus que la stabiliser, à nouveau par l’équilibre glycémique. L’enjeu est alors la prévention des complications de la neuropathie, avec en premier le mal perforant plantaire (cf. infra) (+++).
Le reste du traitement est symptomatique en cas de neuropathie douloureuse :
- antalgiques, dont les antalgiques banals, mais surtout certains antiépileptiques (gabapentine, Neurontin® ; prégabaline, Lyrica®), certains antidépresseurs (tricycliques ; venlafaxine, Effexor® ; duloxétine, Cymbalta®) ;
- hydratation des tissus cutanés (crème, pommade).
V Macroangiopathie
L’atteinte vasculaire concerne également les artères musculaires de calibre > 200 μm. Elle est qualifiée de macroangiopathie et se distingue dans le diabète par sa précocité (athérosclérose accélérée), sa plus grande fréquence, son étendue (sténoses longues, diffuses) et sa sévérité (par exemple, les infarctus du myocarde sont plus souvent mortels). De plus, la paroi artérielle subit un vieillissement accéléré, avec calcification diffuse de la média (médiacalcose). À la radiographie standard, les artères sont alors visibles spontanément, en rail.
A Épidémiologie
La prévention cardiovasculaire est le problème majeur des sujets diabétiques de type 2 : trois quarts d’entre eux mourront d’une cause cardiovasculaire, la moitié d’un infarctus du myocarde. Le risque cardiovasculaire est multiplié par 2 à 3 par le diabète — par 3 à 4 chez la femme, le diabète réduisant considérablement le bénéfice du genre féminin face au risque cardiovasculaire —, indépendamment des autres facteurs de risque fréquemment associés comme l’HTA.
Le surrisque associé au diabète varie selon le lit artériel :
- risque coronarien multiplié par 2 à 3 ;
- risque d’accident vasculaire ischémique multiplié par 1,5 à 2 ;
- risque d’artériopathie oblitérante des membres inférieurs multiplié par 5 à 10.
Les données nationales les plus récentes rapportent : en 2013, en France, parmi les 3 millions de personnes traitées pharmacologiquement pour un diabète, 11 737 ont été hospitalisées pour un infarctus du myocarde (2,2 fois plus que dans la population non diabétique), 17 148 pour un accident vasculaire cérébral (1,6 fois plus), 7 749 pour une amputation d’un membre inférieur (7 fois plus). Les hommes étaient davantage touchés que les femmes par l’ensemble de ces complications. La mortalité des AVC et des infarctus du myocarde est supérieure en cas de diabète (risque de décès multiplié par 2 environ).
B Dépistage et évaluation du risque
Le risque est évalué selon une approche globale, comme détaillé précédemment (cf. Items 222 et 223) ou dans les recommandations de la HAS.
1re étape – Identifier les facteurs de risque, évaluer le risque estimé de coronaropathie
Ceci repose sur la démarche exposée dans le chapitre Facteurs de Risque cardiovasculaire, prévention.
________________________________________________________________________________
Recommandations HAS
De façon abrégée, voici la recommandation reprise par le guide de la HAS.
Les diabétiques à risque cardiovasculaire élevé sont (grade B) :
- ceux ayant une microalbuminurie confirmée ou une protéinurie ou une maladie coronaire silencieuse documentée ;
- ceux ayant au moins deux facteurs de risque parmi les suivants : âge > 50 ans pour les hommes et > 60 ans pour les femmes ou durée de diabète > 10 ans dans les deux sexes, hypertension artérielle, tabagisme, dyslipidémie, antécédents familiaux de maladie cardiovasculaire précoce ;
- ceux ayant un risque cardiovasculaire fatal > 5 % à 10 ans, si un score de risque est utilisé. Le risque cardiovasculaire peut être calculé chez les diabétiques de type 2 en prévention primaire par l’équation de risque de l’UKPDS. Le nombre de diabétiques de type 1 inclus dans les études de prévention cardiovasculaire est toujours très faible. On peut considérer que leur risque cardiovasculaire est élevé lorsque la durée du diabète dépasse 15 ans ou que les mêmes facteurs d’aggravation du risque que chez les diabétiques de type 2 sont présents.
________________________________________________________________________________
2e étape – Mettre en évidence une atteinte artérielle patente
Coronaropathie
- Interrogatoire ciblé, à la recherche d’angor (douleurs thoraciques constrictives) mais aussi de signes moins flagrants car la présentation clinique peut être atypique (voire, bien que ce soit moins fréquent que par le passé, silencieuse, ce qui par définition échappe à l’interrogatoire) :
- troubles digestifsinexpliqués, parfois douleurs épigastriques ;
- asthénie en particulier à l’effort ;
- troubles du rythme cardiaque, embolie ;
- et parfois simple déséquilibre inexpliqué du diabète (de façon générale, tout signe clinique ou déséquilibre glycémique inexpliqué chez un diabétique → ECG systématique) ;
- ou baisse de la pression artérielle.
- ECG de repos annuel systématique.
Quand faut-il recourir à des tests fonctionnels (épreuve d’effort, échocardiographie de stress, scintigraphie myocardique couplée à une épreuve d’effort ou à un stress pharmacologique) en prévention primaire ?
- si symptômes cliniques ou signes à l’ECG, quand la coronarographie n’est pas indiquée d’emblée ;
- chez le patient asymptomatique à risque cardiovasculaire élevé (→ recherche d’ischémie myocardique silencieuse) :antécédent d’AOMI, AVC, protéinurie, ou deux autres facteurs de risque cardiovasculaire associés au diabète (proposition du groupe de travail de la HAS à partir des recommandations de l’ACSM-ADA 2010 et de l’ESC-EASD 2013). Ces situations correspondent en fait à un risque très élevé en général. Les recommandations européennes cardio-diabétologiques citées par la HAS (ESC-EASD, 2013) soulignent que le sujet est controversé, car il n’y a pas de preuve malgré plusieurs essais que le dépistage de l’ischémie myocardique silencieuse aboutisse à un bénéfice pour le patient, si l’on a déjà mis en pratique les recommandations de contrôle des facteurs de risque.
Atteinte carotidienne
- Auscultation des carotides à chaque consultation, recherche de signes déficitaires et d’épisodes compatibles avec un accident ischémique transitoire (AIT).
- Effectuer une échographie-doppler des carotides (angio-IRM si anomalie auscultatoire) en cas de symptomatologie évocatrice d’AIT à l’interrogatoire. Pour certains (non consensuel), elle sera systématique tous les 2 à 5 ans si le risque cardiovasculaire est élevé (en particulier si une HTA est associée).
Artériopathie des membres inférieurs
On effectuera les examens suivants :
- inspection soigneuse des pieds (peau fine, dépilation, pâleur) ;
- recherche des pouls, auscultation des trajets artériels à chaque consultation ;
- recherche d’une symptomatologie de claudication ;
- mesure de l’indice de pression systolique (IPS) cheville/bras (rapport entre la pression artérielle systolique mesurée au bras et celle mesurée à la cheville, avec une sonde doppler pour mesurer la pression occlusive) ;
- recherche de claudicationou de plaie des pieds, IPS abaissé, échographie-doppler des artères des membres inférieurs (à partir de l’aorte abdominale) seulement si une anomalie clinique patente est observée (pas d’échographie-doppler systématique) ;
- angio-IRM ou artériographie ne seront demandées que si une revascularisation est envisagée.
C Diagnostic et présentation clinique
On se reportera aux Items 339 et 340. Quelques spécificités liées au diabète peuvent être retenues :
- le diabétique ayant déjà une atteinte vasculaire : davantage encore que chez le non-diabétique, l’athérosclérose est une maladie systémique ; autrement dit, un souffle fémoral fera aussi rechercher une atteinte coronarienne ou carotidienne, par exemple ;
- on notera également une autre spécificité de l’artériopathie des membres inférieurs chez le diabétique. Outre l’association fréquente à une neuropathie responsable du caractère indolore de l’ischémie, l’artérite des membres inférieurs du diabétique est caractérisée par sa topographie souvent multi-étagée.
D Traitement
La prévention est essentielle, primaire ou secondaire. La HAS recommande un traitement médicamenteux au-delà du contrôle glycémique et des modifications du style de vie.
________________________________________________________________________________
Évaluer le risque cardiovasculaire global du patient et prescrire :
- en prévention cardiovasculaire secondaire : une statine, un antiagrégant plaquettaire (acide acétylsalicylique) et un IEC (ou ARA II) ;
- en prévention primaire : une statine chez les patients ayant un risque cardiovasculaire élevé et un IEC (ou ARA II) en cas d’HTA et/ou d’albuminurie confirmée.
En prévention primaire, la prescription d’un antiagrégant plaquettaire est beaucoup moins largement recommandée qu’auparavant. En résumé, elle n’est recommandée que quand le risque cardiovasculaire est très élevé et le risque de saignement limité (cf. infra).
________________________________________________________________________________
1 Contrôle glycémique
L’association entre contrôle glycémique et risque de macroangiopathie est nette, mais on peine à identifier un seuil d’HbA1c en dessous duquel le risque est réduit à celui des non-diabétiques.
On a longtemps pensé que viser le meilleur contrôle glycémique était bénéfique pour le patient. Les études récentes (ACCORD, ADVANCE et VADT) suggèrent qu’en dessous de 7 % d’HbA1c moyenne sur le long terme, le bénéfice est faible, cependant que le risque thérapeutique (hypoglycémies, iatrogénie) devient significatif. Ainsi, si un objectif de 6,5 % est souhaitable pour un patient jeune et en prévention primaire, 7 % paraît plus raisonnable chez des patients plus âgés ou à plus fort risque, comme rappelé dans les recommandations HAS 2013 sur la prise en charge thérapeutique des sujets diabétiques de type 2.
Rappelons que la metformine est de prescription systématique chez le diabétique de type 2 en surpoids, ce qui est généralement le cas. C’est sans doute encore plus vrai chez le diabétique coronarien (+++).
En phase aiguë (syndrome coronarien aigu, mais peut-être aussi AVC ischémique), le contrôle glycémique le plus proche de la normale semble être un élément pronostique important, en évitant la survenue d’hypoglycémies ; or, la crainte de l’hypoglycémie fait souvent laisser les patients en hyperglycémie marquée, alors que le risque d’hypoglycémie peut être limité par la simple surveillance rapprochée des glycémies capillaires.
2 Activité physique
Elle est systématiquement recommandée, à un niveau adapté au patient.
Cette partie n’est pas différente, en dehors de la rééducation après coronaropathie patente (qui est très importante), des recommandations rappelées dans la section consacrée aux règles hygiéno-diététiques de prise en charge du diabète de type 2.
3 Contrôle lipidique (+++)
Se reporter au chapitre 9 sur les facteurs de risque cardiovasculaire et les objectifs de concentration du LDL-cholestérol.
4 Contrôle de la pression artérielle
L’objectif tensionnel général est < 140/90 mmHg. L’objectif est à adapter suivant les patients, suivant le risque d’hypotension orthostatique chez la personne âgée, chez les personnes atteintes de neuropathie cardiaque autonome et suivant les traitements associés. Comme mentionné ci-dessus, on peut être plus ambitieux (PAS < 130 mmHg) chez des patients jeunes ou susceptibles de tirer un bénéfice particulier de la baisse de la pression artérielle (antécédent d’atteinte rénale ou d’AVC).
5 Prévention du risque thrombotique
Les antiagrégants plaquettaires n’ont plus de place en prévention cardiovasculaire primaire, leur bénéfice dans cette situation semblant outrepassé par les risques hémorragiques. Les antiagrégants plaquettaires sont en revanche indiqués en prévention secondaire des pathologies cardiovasculaires.
6 Contrôle du poids
Les objectifs sont une réduction pondérale de 5 à 10 % sur un an chez les individus en surpoids ou obèses : une perte plus marquée favorise le yoyo pondéral, lui-même associé à un risque cardiovasculaire accru. L’enjeu est la maintenance du bénéfice obtenu les premiers mois — la reprise de poids à un an est extrêmement fréquente. L’application de mesures hygiénodiététiques est systématique, avec soutien motivationnel. Au-delà d’un éventuel contrôle des apports caloriques de l’alimentation, la composition équilibrée est recommandée. Le régime méditerranéen, riche en noix, huile d’olive notamment, et pauvre en protéines et graisses d’origine animale est recommandé, mais il faut bien sûr tenir compte des habitudes culturelles.
7 Sevrage tabagique
Arrêt du tabac, associé si besoin à un accompagnement du sevrage tabagique. Une prise en charge spécialisée est recommandée chez les personnes fortement dépendantes ou souffrant de co-addictions multiples ou présentant un terrain anxiodépressif. Il est nécessaire d’anticiper les risques de déséquilibre du diabète par la polyphagie réactionnelle et la modification transitoire de la sensibilité à l’insuline.
8 Revascularisation
Les stratégies de revascularisation sont similaires à celles des non-diabétiques, avec quelques spécificités pour l’atteinte coronaire :
- la mise en évidence d’une ischémie myocardique silencieuse avec sténoses à la coronarographie implique une optimisation de la prise en charge médicale des facteurs de risque, mais pas nécessairement une revascularisation. Les arguments en faveur de celle-ci sont notamment : atteinte de plusieurs coronaires, observance probable des traitements antiagrégants, souhait du patient ;
- si une revascularisation est indiquée, étant donné le risque accru chez le diabétique de resténose, la pose de stents, si possible actifs (stents couverts), est la règle ;
- atteinte tritronculaire : chirurgie (pontage aortocoronarien) plutôt qu’angioplastie percutanée.
VI Pied diabétique
(Cf. également Item 156 – Infections ostéoarticulaires.)
Actuellement, au cours de sa vie, un patient diabétique sur dix risque de subir au moins une amputation d’orteil. En 2013, en France, parmi les 3 millions de personnes traitées pharmacologiquement pour un diabète, 20 493 ont été hospitalisées pour une plaie du pied (5 fois plus qu’en l’absence de diabète) et 7 749 pour une amputation d’un membre inférieur (7 fois plus). Plus encore que pour les complications cardiovasculaires, la précarité sociale constitue un facteur de risque de plaie du pied et d’amputation (InVS, 2015). Mais cela n’est pas une fatalité. On peut éviter les plaies, et en évitant les plaies, on prévient l’amputation.
A Physiopathologie
La neuropathie et l’artériopathie sont le terrain de l’apparition des plaies podologiques, seules ou en combinaison. L’éventail des plaies va du mal perforant plantaire (neuropathie pure) à la plaie ischémique d’orteil ou de membre (artériopathie pure). L’infection peut survenir sur l’un ou l’autre de ces processus et constitue un facteur aggravant. La plaie est quasiment toujours d’origine mécanique (kératose, chaussure, agression externe).
B Dépistage
Les patients à risque de faire une plaie chronique sont dits « à risque podologique ». Ce risque concerne :
- les patients diabétiques artéritiques : claudication, pouls abolis ou faibles, indice de pression systolique anormal ;
- les patients diabétiques ayant une neuropathie compliquée d’un trouble de la statique du pied et de façon générale les déformations du pied ;
- les patients diabétiques ayant des troubles de la sensibilité algique, vibratoire, thermique et profonde ;
- tout patient diabétique ayant des antécédents d’ulcération au niveau des pieds.
La classification internationale du risque de plaie podologique chez le diabétique indique les grades suivants :
- grade 0 : absence de neuropathie sensitive et d’artériopathie ;
- grade 1 : présence d’une neuropathie sensitive isolée ;
- grade 2 : association de la neuropathie à l’artériopathie ou aux déformations des pieds ;
- grade 3 : antécédents d’ulcération ou d’amputation.
À chaque grade correspondent des mesures de prévention. Cette classification n’est pas une gradation de la neuropathie distale ; la neuropathie distale doit être caractérisée par le type des sensibilités concernées et le niveau proximal de cette atteinte (pied, cheville, mollet, genou, etc.).
C Prévention
La prévention (+++) repose en premier lieu sur le patient, qui doit être formé (c‘est un des objectifs majeurs de l‘éducation thérapeutique dans le diabète) : autosurveillance des pieds et précautions pour le chaussage et l’hygiène (cf. infra, « Ce que le patient doit savoir »). Un suivi par pédicure-podologue est conseillé si le patient et son entourage ont des difficultés à assurer eux-mêmes ces missions. Si le risque podologique est de grade 2, quatre consultations par an sont prises en charge par la CPAM ; si le risque est de grade 3, six consultations par an. Ce nombre va évoluer respectivement à cinq et huit séances dans le courant de l’année 2021 suite à la signature d’un nouvel avenant à la convention. Une ordonnance doit être remise avec ces indications (niveau de risque et nombre de consultations). Des semelles et chaussures sur-mesure pour décharge des zones d’appui anormal peuvent être prescrites et sont remboursées.
Elle repose sur la surveillance par les soignants : à chaque consultation des patients à risque et chez tous annuellement au moins, déchaussage systématique pour examen clinique : état cutané (sécheresse, sueurs et macération aux plis, infections fongiques, zones d’hyperkératose, cors, déformation, froideur cutanée, infection fongique, neuropathie avec test au monofilament, statut vasculaire).
La prévention est aussi celle de l’aggravation : devant toute plaie nouvellement apparue, le patient et ses soignants doivent prendre un avis d’expert (équipe pluridisciplinaire idéalement) sans délai.
D Mal perforant plantaire, ou plaie neuropathique
Les points d’appui du pied normal sont au nombre de sept, dont :
- les cinq têtes des métatarsiens ;
- la styloïde du 5e métatarsien au bord latéral du pied ;
- le talon.
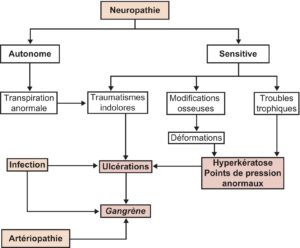
La neuropathie entraîne une hypoesthésie et favorise les déformations ostéoarticulaires, elle altère la fonction des glandes sudoripares et sébacées (pieds secs, hyperkératose, crevasses qui font le lit de l’infection). C’est au niveau de ces points d’appui que se développent les durillons (hyperkératose) qui feront le lit des maux perforants plantaires (fig. 12). C’est en effet le durillon qui creuse la plaie.
________________________________________________________________________________
Fig. 12.
Facteurs favorisant l’apparition du mal perforant.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
Après ces déformations, les points d’appui anormaux subissent une pression permanente excessive. La réaction de l’organisme, favorisée par la sécheresse cutanée, est l’hyperkératose. Elle peut être majeure et constituer un durillon, équivalent de corps étranger. C’est l’absence de douleur (c’est-à-dire de signe d’alerte) qui va être responsable de la deuxième étape : à chaque pas, à chaque appui, le durillon s’appuie dans les tissus mous sous-jacents. Cette pression répétée mille fois par jour va conduire à une dilacération des tissus mous et à la formation de collections stériles sous la corne. Le durillon peut se fissurer en créant une porte d’entrée pour les germes cutanés vers la collection, milieu de culture idéal. À cette étape peut se former une collection infectée, c’est-à-dire un abcès sous le durillon, qui peut évoluer vers la dermohypodermite et après quelques semaines d’évolution vers l’ostéite.
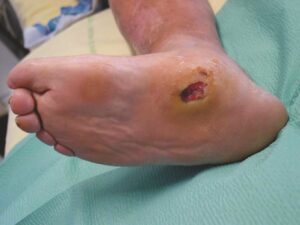
Le mal perforant (fig. 13) peut donc se révéler par l’une des manifestations suivantes :
- du pus va sourdre par l’une des fissures du durillon, tachant la chaussette ;
- un érysipèle (dermohypodermite bactérienne aiguë non nécrosante), le mal perforant constituant une porte d’entrée bactérienne ;
- une infection plus sévère de type cellulite avec fonte purulente localisée des tissus adipeux et musculaires sera une révélation bruyante, parfois avec signes systémiques (fièvre, frissons, syndrome inflammatoire biologique et hyperleucocytose).
________________________________________________________________________________
Fig. 13.
Aspect typique de mal perforant sur un fond d’hyperkératose.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
E Ischémie ou nécrose
Si une AOMI est présente, la physiopathologie est généralement une oblitération ou une sténose des artères de moyen à petit calibre, distales, par prolifération, fibrose puis calcification de l’intima et de la media (médiacalcose), caractéristique du diabète et du vieillissement, à la différence des plaques d’athéromes proximales chez les sujets tabagiques. La peau est froide, fine, dépilée, le temps de recoloration cutanée est supérieur à 3 secondes.
Si une petite plaie survient, les besoins de flux sanguin local pour lutter contre la micro-infection locale et pour cicatriser sont décuplés, alors que le flux sanguin était déjà à son maximum. La moindre plaie (piqûre de la peau lors du coupage des ongles, couture un peu saillante dans la chaussure, fissure au fond d’un banal intertrigo candidosique) va déséquilibrer la situation et cette petite zone va être en ischémie relative, elle va noircir. Le processus est alors engagé et peut aller très vite (quelques heures à quelques jours) : l’organisme devrait fournir encore plus d’oxygène pour cette zone et, comme il ne peut le faire, cette boucle vicieuse se répète jusqu’à ce que l’orteil entier, l’avant-pied ou le pied entier soit noir. L’urgence est de revasculariser, pas d’amputer : la plaie post-amputation ne cicatriserait pas.
F Lésions complexes
Très souvent la neuropathie et l’artériopathie coexistent. Le mal perforant peut alors se compliquer de nécrose. La priorité est la revascularisation. L’infection nécessite une antibiothérapie, mais l’antibiotique ne peut parvenir là où il est utile que si la perfusion sanguine est suffisante ; c’est dire l’importance d’assurer une perfusion suffisante.
G Dermohypodermite nécrosante
Survenant dans de très rares cas, il s’agit d’une urgence infectieuse vitale. Le tableau septique est au premier plan, le teint est gris, l’hémodynamique altérée, l’odeur de la plaie fétide. Il faut débrider la plaie en urgence au bloc et initier des antibiotiques.
Un cas particulier est la très rare gangrène gazeuse, dont le germe responsable est en général le Clostridium perfringens. La présence de gaz dans les chairs se manifeste par des crépitations à la palpation (crissement de la marche dans la neige) et des clartés (taches de 1 mm environ) dans les parties molles à la radiographie standard. Il s’agit d’une urgence vitale, l’amputation est nécessaire dans les heures qui suivent, ainsi qu’une réanimation comprenant une antibiothérapie parentérale par pénicilline.
H Conduite à tenir en urgence devant une plaie de pied diabétique
________________________________________________________________________________
Ce que doit faire l’interne de garde aux urgences devant une plaie de pied chez un patient diabétique
- Recueillir les données de l’interrogatoire et de l’examen permettant de dater l’apparition de la lésion du pied et de qualifier celle-ci de neuropathique (antécédents podologiques, sensibilité atténuée du pied controlatéral, hyperkératose, déformations) et/ou d’artériopathique (facteurs de risque et antécédents cardiovasculaires, pouls distaux abolis, souffles vasculaires).
- Localiser la plaie : plutôt en regard d’un point d’appui très sollicité, d’un durillon, neuropathique.
- Rechercher des signes locaux d’infection : rougeur, chaleur, douleur, tuméfaction, écoulement purulent.
- Évaluer l’état vasculaire : recherche d’une nécrose, évaluation du temps de recoloration cutanée, mesure de l’indice de pression systolique : un IPS < 0,9 signe l’artériopathie, < 0,5 une ischémie critique.
- Rechercher la présence de décollements cutanés avec flaques hémorragiques et pus qui signent la gangrène humide.
- Vérifier les signes locaux de diffusion : lymphangite, œdème, fusée plantaire, érysipèle, adénopathie, etc. Le diagnostic d’infection est en effet clinique.
- Vérifier les signes généraux, présents (fièvre, frissons, teint gris) ou non.
- Coter la douleur.
Au terme de cette approche seront précisés :
- le terrain : neuropathie et/ou artériopathie ;
- la présence d’une complication : infection, ischémie ;
- la sévérité : urgence vitale (gangrène, tableau de septicémie) ou non.
Les décisions à prendre sont :
- Quel avis demander ?
- l’orthopédiste uniquement s’il est nécessaire de drainer une infection purulente ou dans le cas rarissime de la gangrène gazeuse ;
- le chirurgien vasculaire en cas de doute sur une participation ischémique, pour discuter d’une revascularisation en urgence ;
- rarement, le réanimateur si le tableau septique est sévère.
- Quel examen prescrire le jour même ?
- radiographie des pieds, centrée sur la zone atteinte, bilatérale pour comparaison, à la recherche d’une ostéite (cf. infra), de fractures pathologiques, de corps étrangers, de gaz dans les tissus mous ;
- en cas d’infection clinique seulement (sinon ce peut être différé) : NFS, ionogramme sanguin avec créatininémie, CRP (en l’absence de signe systémique, hyperleucocytose et élévation de la CRP, la mesure de la VS est un meilleur moyen de détecter les infections osseuses locales), hémocultures s’il y a lieu (signes généraux, frissons, fièvre).
- Quelle surveillance prescrire ? Uniquement si l’état clinique le justifie (infection avec signes systémiques), on surveillera pouls, pression artérielle, température/8 heures, diurèse, glycémie horaire, initialement.
- Quel traitement prescrire ?
- la mise en décharge (suppression totale de l’appui sur la plaie) est systématique ; si le patient est traité en ambulatoire, il doit repartir avec une ordonnance de « chaussure de décharge » et un arrêt de travail ;
- excision de l’hyperkératose par une IDE à domicile (ne pas oublier de prescrire des sets de détersion avec bistouris) ;
- en cas d’infection clinique uniquement, parage et drainage de la plaie si nécessaire, prélèvement en profondeur (écouvillon et cathéter souple utilisé pour les prélèvements sanguins, visant à aspirer une sérosité et du pus en profondeur) et recherche d’un contact osseux avec un stylet à pointe mousse ; un écouvillon superficiel n’a aucune valeur diagnostique ou d’orientation bactériologique ;
- antibiothérapie non systématique : uniquement si infection clinique (une plaie avec de la fibrine n’est pas septique) ;
- anticoagulation à dose préventive uniquement si hospitalisation et alitement ;
- traitement antalgique s’il y a lieu ;
- réhydratation en fonction de l’état hémodynamique ;
- protocole de contrôle de la glycémie ;
- matelas anti-escarre ou coussin relève-jambe en cas de participation ischémique ;
- mise à jour de la vaccination antitétanique [l’oublier expose à des déconvenues majeures lors des ECN…] ;
- il n’y a pas de recommandation consensuelle de pansements spéciaux ou de topiques de type facteurs de croissance tissulaire ; cependant de récents essais randomisés pourraient faire évoluer cette situation.
L’antibiothérapie n’est indiquée en urgence qu’en cas de signes généraux et d’infection cutanée (dermohypodermite). Elle doit couvrir les cocci Gram-positifs et les anaérobies. Pour exemple, citons l’amoxicilline-acide clavulanique (per os ou IV, selon la situation). Ce traitement est prescrit pour une courte durée. En cas de suspicion d’infection ostéoarticulaire, on se doit d’avoir une preuve bactériologique ; celle-ci sera obtenue après la fin du traitement de la dermohypodermite et une fenêtre thérapeutique. Traiter une infection osseuse n’est pas une urgence.
________________________________________________________________________________
Ostéite
C’est une complication grave mais ce n’est pas une urgence médicale. Le diagnostic repose le plus souvent sur la radiographie standard, qu’il faut savoir répéter car les signes sont retardés. Une radiographie typique en regard de la plaie avec un contact osseux positif recherché à l’aide d’une pointe mousse a une très bonne valeur prédictive positive.
En cas de doute, on peut avoir recours à des examens plus complexes : IRM (qui doit être interprétée par un radiologue averti), scintigraphie (gallium, polynucléaires marqués), biopsie osseuse (passant en peau saine et effectuée après 15 jours d’arrêt des antibiotiques). Le traitement repose soit sur une résection chirurgicale de l’articulation infectée, soit sur une antibiothérapie de 6 à 12 semaines avec suppression totale de l’appui.
________________________________________________________________________________
Ce que le patient doit connaître
Pied diabétique
Patient diabétique sans risque (grade 0)
Il doit savoir comment le rester :
- avec un bon équilibre glycémique ;
- avec une prise en charge des facteurs de risque cardiovasculaire, en particulier l’arrêt de l’intoxication tabagique.
Patient à risque, dit de grade 1, 2 ou 3
Il doit savoir comment protéger ses pieds :
- éviter les situations qui mettent le pied en danger :
- ne pas marcher pieds nus, par exemple à la plage ;
- ne pas couper les ongles, mais plutôt les limer ;
- ne pas enlever les cors ou les callosités avec des instruments tranchants, mais les poncer ;
- ne pas utiliser de substances corrosives telles que des coricides ;
- ne pas utiliser de bouillotte ou de coussin électrique pour se réchauffer les pieds ;
- favoriser les méthodes qui protègent le pied :
- inspecter les pieds chaque jour, avec l’aide d’un miroir si nécessaire ;
- vérifier en y passant la main ou en les secouant l’absence de corps étranger dans les chaussures avant de les enfiler ;
- laver les pieds chaque jour à l’eau tempérée et les sécher soigneusement, surtout entre les orteils ;
- hydrater les pieds quotidiennement en cas de sécheresse de la peau (crème hydratante) ;
- recourir régulièrement à des soins de pédicurie auprès d’un professionnel ayant l’habitude de suivre les patients diabétiques (si le risque podologique est de grade 2, cinq consultations par an sont prises en charge par la CPAM ; si le risque est de grade 3, huit consultations par an). Une ordonnance doit être remise avec ces indications (niveau de risque et nombre de consultations) ;
- porter des chaussures adaptées en cuir, larges, avec des semelles souples, sans brides ou lanières, sans coutures intérieures, et fermées ; le fait que la chaussure soit confortable n’est pas une garantie de qualité ;
- changer de paire de chaussures dans la journée ; ne porter les nouvelles chaussures que durant une heure les premiers jours et inspecter les éventuels points de frottement ;
- porter des chaussettes de coton, de laine ou de soie, si possible ; les changer tous les jours ;
- éviter les élastiques qui serrent le mollet.
________________________________________________________________________________
VII Autres complications
A Peau et diabète
1 Nécrobiose lipoïdique
La nécrobiose lipoïdique est une complication rare (0,3 % à 1 % des patients) et non spécifique du diabète. Sa physiopathologie est incertaine. Elle survient plutôt chez des diabétiques de type 1 jeunes (fig. 14).
________________________________________________________________________________
Fig. 14.
Nécrobiose lipoïdique sur la face antérieure de la jambe d’un patient diabétique de type 1.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
2 Dermopathie diabétique
La dermopathie diabétique est fréquente : elle pourrait concerner jusqu’à 50 % des diabétiques, mais elle est aussi très fréquente dans la population générale. Elle s’associe aux autres complications spécifiques du diabète. Elle réalise des cicatrices atrophiques brunâtres, en particulier sur la face antérieure des tibias. Il n’y a pas de traitement et les lésions tendent à régresser spontanément.
3 Bullose diabétique
Des bulles sont parfois observées ; elles s’associent à la neuropathie, chez le sujet âgé. Elles sont de taille variée, de quelques millimètres à plusieurs centimètres. Elles cicatrisent spontanément en quelques semaines.
4 Lipodystrophies
Les lipodystrophies, le plus souvent hypertrophiques, sont la conséquence d’erreurs dans la technique d’injection d’insuline : injections faites trop souvent au même endroit (fig. 15). Elles altèrent la cinétique de résorption de l’insuline, source importante d’instabilité glycémique. Histologiquement, il s’agit de la prolifération d’adipocytes sous-cutanés. Elles réalisent un épaississement local de la peau et doivent être recherchées au niveau des points d’injection chez tous les diabétiques traités par insuline.
________________________________________________________________________________
Fig. 15.
Lipohypertrophie abdominale.
(Source : cliché aimablement mis à notre disposition par le Dr Agnès Sola.)
________________________________________________________________________________
5 Acanthosis nigricans
L’acanthosis nigricans se manifeste par des placards cutanés brunâtres du cou, à surface veloutée, donnant un aspect « sale ». Les formes sévères se localisent aussi aux aisselles et plis inguinaux. C’est un signe d’insulinorésistance (fig. 16).
________________________________________________________________________________
Fig. 16.
Acanthosis nigricans en zone cervicale postérieure.
(Source : CEEDMM, 2021.)

________________________________________________________________________________
6 Vitiligo
Le vitiligo est une pathologie auto-immune des mélanocytes se manifestant par des taches achromiques. Il s’associe au diabète de type 1 (fig. 17).
________________________________________________________________________________
Fig. 17.
Vitiligo sur les avant-bras.
(Source : CEEDMM, 2021.)
________________________________________________________________________________
7 Xanthomatose éruptive
La xanthomatose éruptive se voit dans les grandes hypertriglycéridémies et se manifeste par des nodules rouge-jaune mesurant jusqu’à 0,5 cm. On les observe sur les cuisses, les fesses et les paumes des mains.
B Infections et diabète
De multiples infections bactériennes sont plus fréquentes chez les diabétiques. Les fonctions des polynucléaires sont altérées lorsqu’ils sont exposés à des concentrations de glucose élevées.
C Foie et diabète
Obésité et résistance à l’action de l’insuline sont des déterminants majeurs des hépatopathies métaboliques : stéatose hépatique, stéato-hépatite et leur complication, la cirrhose.
Cinquante à 60 % des diabétiques de type 2 ont une hépatopathie métabolique. On estime que 5 % des diabétiques ont des lésions de fibrose hépatique sévère, une prévalence 2 fois supérieure à celle de la population générale. Le risque relatif de cirrhose est 2,5 fois celui de la population générale. L’hépatopathie métabolique est un facteur de risque de mortalité, par cancer et maladie cardiovasculaire.
Il est nécessaire de référer le patient diabétique à l’hépatologue, pour bilan, dès anomalie même modérée des transaminases ou des γGT. La mesure de l’élasticité du foie (par élastométrie) permet d’évaluer simplement la fibrose hépatique et de sélectionner les patients qui requièrent une biopsie.
D Articulations et diabète
1 Capsulite rétractile
La capsulite est une complication fréquente qui se manifeste par des douleurs diffuses des épaules et une limitation des mouvements actifs et passifs de l’épaule.
La capsule est épaissie et adhère à la tête de l’humérus. Elle est 4 fois plus fréquente chez les diabétiques et un quart des patients ayant une capsulite sont diabétiques. Le traitement repose sur les antalgiques ; les corticoïdes locaux (qui peuvent déséquilibrer le diabète) sont habituellement nécessaires, ils doivent précéder la physiothérapie. La guérison est habituelle mais peut prendre plus de 6 mois. Elle peut récidiver sur l’autre épaule.
2 Maladie de Dupuytren
La maladie de Dupuytren (sclérose rétractile de l’aponévrose palmaire moyenne) est plus fréquente chez les diabétiques ; 25 % des patients ayant une maladie de Dupuytren sont diabétiques.
3 Chéiroarthropathie
C’est une manifestation de la glycation du collagène, dépendant donc de la durée et de l’importance de l’hyperglycémie chronique. C’est une raideur des doigts ; la peau est épaissie, cireuse, réalisant parfois un aspect pseudo-sclérodermique. L’arthropathie se manifeste par l’impossibilité d’accoler les deux annulaires l’un sur l’autre (signe de la prière).
4 Arthrose
L’arthrose est fréquente chez les diabétiques de type 2, ce qui n’est pas étonnant vu que ces deux pathologies partagent des facteurs de risque commun : âge et surpoids. Les articulations portantes (rachis, hanches et genoux) sont les plus fréquemment concernées. On décrit cependant chez l’obèse une plus grande fréquence des arthroses digitales, ce qui laisse penser que des facteurs autres que mécaniques sont en jeu.
E Dents et diabète
La nécessité de soins dentaires est une généralité particulièrement pertinente chez le diabétique, qui encourt essentiellement la maladie parodontale. Il s’agit d’une pathologie destructive, forme grave d’inflammation des gencives, qui est la principale cause de la perte des dents chez l’adulte.
Une autre complication du diabétique au niveau dentaire concerne la survenue d’infections et d’abcès dentaires, d’autant que le diabète est déséquilibré.
La relation est réciproque : sans doute par l’inflammation subaiguë qu’elle entretient, la parodontopathie participe à déséquilibrer le diabète. Un essai randomisé a démontré que soigner la parodontopathie avait aussi pour conséquence un meilleur équilibre glycémique.
________________________________________________________________________________
Suivi du diabétique de type 2
Nous nous fondons sur les recommandations de la HAS.
Recherche d’atteinte d’organes cibles
La recherche d’éventuelles complications (symptomatiques ou non) oculaires, rénales, neurologiques, cardiovasculaires (insuffisance myocardique, artériopathies) et de lésions du pied doit être effectuée de manière systématique au travers de l’interrogatoire, de l’examen clinique et d’actes et examens spécifiques. Le bilan peut nécessiter plusieurs consultations et, dans certains cas, le recours à des avis spécialisés.
Examens complémentaires
Les actes techniques suivants sont réalisés :
- examen annuel de la rétine (rétinographe sans dilatation), qui ne dispense pas d’un examen ophtalmologique éventuel pour la mesure de la réfraction, du tonus oculaire, pour l’examen du cristallin et des autres structures de l’œil ;
- ECG de repos annuel, systématique ;
- bilan cardiologique pour dépister l’ischémie myocardique asymptomatique chez le sujet à risque cardiovasculaire élevé ; la nature de ce bilan n’est actuellement pas codifiée. Les sociétés savantes (SFD, SFC) recommandent également chez certains sujets (prévention primaire, risque intermédiaire ou élevé) la mesure du score calcique coronaire pour mieux estimer le niveau de risque cardiovasculaire. L’épreuve d’effort permet aussi d’évaluer les capacités des patients à fournir un effort ;
- échodoppler des membres inférieurs : c’est un examen qui évalue la topographie des lésions ; il ne devrait être pratiqué que chez des patients chez qui on envisage une revascularisation : plaie du pied, artériopathie symptomatique. Le diagnostic de l’artériopathie repose sur la mesure de l’indice de pression systolique (IPS) cheville/bras qui peut être fait avec un doppler de poche ou un tensiomètre automatique professionnel ;
- la pratique du doppler des troncs supra-aortiques n’est pas codifiée. Des signes d’appel (souffle, symptômes neurologiques, imagerie cérébrale évocatrice) le justifient. Chez les patients asymptomatiques, ni la sélection des patients qui devraient recevoir cet examen, ni sa fréquence de répétition ne sont consensuelles.
Suivi biologique
Le suivi biologique concerne :
- l’HbA1c (4 fois par an, 2 fois par an chez les diabétiques de type 2 qui sont à l’objectif et dont le traitement n’est pas modifié) ;
- le bilan lipidique (cholestérol total, HDLc, triglycérides, calcul du LDLc) une fois par an ;
- la recherche de microalbuminurie (mesure du ratio Microalbumine/Créatinine sur échantillon urinaire) une fois par an ;
- la créatininémie, une fois par an ; plus fréquemment en présence d’une insuffisance rénale, en particulier en cas de prescription de metformine ;
- une évaluation du débit de filtration glomérulaire (formule du CKD-EPI, avec dosage de la cystatine C chez les patients obèses ou dénutris, selon les recommandations du KDIGO) ;
- la TSH, annuelle chez les patients diabétiques de type 1 qui ont des anticorps anti-thyroperoxydase.
________________________________________________________________________________
VIII Complications métaboliques du diabète
A « Coma » cétoacidosique
Plusieurs définitions de la cétoacidose coexistent ; nous retiendrons celle de l’American Diabetes Association :
- cétonémie (> 3 mmol/l) ou cétonurie (> « ++ ») significative ;
- glycémie > 250 mg/dl ;
- bicarbonate < 18 mmol/l et/ou pH veineux < 7,30.
On notera dans cette définition :
- que c’est plutôt la cétonémie que la cétonurie qui est recommandée ;
- qu’on peut être en cétoacidose sans être en franche hyperglycémie (c’est le cas par exemple au cours de la grossesse ou avec les médicaments inhibiteurs de SGLT2) ;
- qu’il n’est pas besoin systématique d’un prélèvement artériel, toutes les données nécessaires, y compris le pH sont mesurées sur sang veineux.
L’incidence annuelle est difficile à établir, de l’ordre de 5 à 8 épisodes pour 1 000 patients par an, avec des facteurs de risque qu’il faut connaître : courte durée de diabète, antécédents psychiatriques, gastroparésie, HbA1c élevée. La mortalité est de l’ordre de 1 % dans les pays développés, essentiellement due à la pathologie causale. Cependant il y a encore une mortalité propre de la cétoacidose, souvent iatrogène : œdème cérébral chez l’enfant, hypokaliémie, détresse respiratoire.
1 Étiologie
Il peut s’agir :
- d’un déficit absolu en insuline, inaugural dans le diabète de type 1 ;
- ou d’un arrêt, volontaire ou non, de l’insulinothérapie ; la cause en est le plus souvent une conduite inappropriée de réduction des doses d’insuline en situation de pathologie intercurrente. La baisse des doses précipite la situation à un moment où il aurait fallu augmenter, à cause de la résistance à l’insuline induite par la pathologie intercurrente (cortisol, GH, catécholamines). Cette gestion est en général due à une mauvaise analyse des signes d’alerte, en particulier les signes digestifs de la cétose : nausées et vomissements.
Dans le diabète de type 2, la cétoacidose est en général le fait d’une pathologie intercurrente sévère (chirurgicale, infarctus, etc.), mais d’autres causes existent : diabète de type 2 à tendance cétosique du sujet africain, effets indésirables des corticoïdes, des immunomodulateurs, des inhibiteurs de SGLT2.
Dans tous les cas, une pathologie intercurrente doit être recherchée ; l’arrêt de l’insuline ne peut pas être retenu comme cause unique sans la recherche systématique de causes autres, infectieuses en particulier.
2 Diagnostic et évolution
Phase de cétose
Un syndrome cardinal aggravé est observé (soif, sécheresse buccale, polyurie, perte de poids), associé à des troubles digestifs (nausées, vomissements, douleurs abdominales).
Phase de cétoacidose
Elle est caractérisée par une dyspnée de Kussmaul, rarement associée à des troubles de la conscience (état stuporeux) et à une déshydratation mixte à prédominance extracellulaire.
________________________________________________________________________________
Critères de gravité
Les critères de gravité imposant l’hospitalisation en réanimation sont les suivants (consensus britannique) :
- sujet âgé ;
- cétonémie > 6 mmol/l ;
- bicarbonate < 5 mmol/l ;
- pH artériel ou veineux < 7 ;
- hypokaliémie, < 3,5 mmol/l à l’admission ;
- score de l’échelle de Glasgow < 12 ;
- SaO2 < 92 % ;
- PA systolique < 90 mmHg ;
- fréquence cardiaque > 100 ou < 60 bpm ;
- trou anionique (Na+ + K+) – (Cl– + HCO3–) > 16.
________________________________________________________________________________
3 Diagnostic différentiel
- Urgence abdominale : mais l’urgence abdominale (pancréatite, urgences chirurgicales) peut être une cause de cétoacidose chez le diabétique. L’élévation des enzymes pancréatiques est habituelle au cours de la cétoacidose. Dans tous les cas, la chirurgie ne doit pas être faite avant résolution des désordres hydroélectrolytiques.
- Le coma hyperosmolaire (glycémie plus élevée, insuffisance rénale, pas d’élévation de la cétonémie).
4 Évolution
On note l’évolution suivante :
- régression sous traitement en 24 à 48 heures ;
- complications iatrogènes : œdème cérébral, surcharge hydrosodée, hypokaliémie +++, hypophosphorémie.
5 Traitement
Ce qui peut être fait par tout médecin
- Confirmation de la présence d’acétone devant un tableau clinique évocateur (cétonémie ≥ 3 mmol/l ou cétonurie > « ++ »).
- Évaluation clinique de la gravité (âge, terrain, pathologie intercurrente, signes de détresse respiratoire, situation hémodynamique, niveau de conscience, tolérance digestive, importance de la déshydratation…).
- Orientation immédiate du patient vers un service d’urgence en cas de signes de gravité et/ou d’éléments faisant suspecter l’incapacité du patient à gérer la situation au domicile (intolérance digestive totale, démotivation, pas d’insuline rapide à disposition…).
Les patients sans signe de gravité (cf. supra), bien éduqués à l’autoprise en charge de cette situation, ayant accès à une insuline rapide, pouvant contrôler régulièrement leur taux de glucose et leur cétonémie peuvent être encouragés à rester à domicile, sous réserve qu’ils puissent contacter un service référent en cas d’aggravation. Ils doivent alors être encouragés à réaliser au plus vite une dose SC d’insuline rapide sous contrôle rapproché du taux de glucose et de la cétonémie.
Premiers gestes aux urgences
- Poser une voie veineuse et débuter la réhydratation (sérum salé 0,9 %).
- pH (sang veineux), bicarbonates, ionogramme, créatininémie, protidémie, hématocrite, CRP.
- Bilan à la recherche d’une infection causale.
- ECG.
Il est préférable de ne pas débuter l’insuline et la supplémentation potassique tant qu’on n’a pas le résultat de la mesure de la kaliémie : une kaliémie basse (< 3,5 mmol/l) impose de débuter la supplémentation potassique avant de débuter l’insuline, une kaliémie haute (> 5 mmol/l) doit faire reporter le début de la supplémentation potassique.
Traitement curatif
Idéalement en service de diabétologie ou en soins intensifs/réanimation en cas de signes de gravité.
Le traitement curatif requiert :
- l’insuline rapide ou ultrarapide en perfusion IV continue, 0,1 U/kg/h, sans dépasser 7 à 8 U/h, tant que dure la cétose :
- des débits supérieurs n’accélèrent pas la sortie de l’épisode et augmentent le risque d’hypokaliémie ;
- pour favoriser le relais de l’insuline IV à l’insuline sous-cutanée, le consensus britannique recommande de maintenir l’insuline basale sous-cutanée du patient ;
- si la glycémie baisse en dessous de 2,5 g/l alors que la cétonémie persiste, il faut maintenir le débit de perfusion de l’insuline et perfuser en parallèle du sérum salé du glucose (sur la basse de 2 litres de glucosé 10 % par 24 heures) ;
- le relais de l’insuline IV à l’insuline sous-cutanée est envisagé lorsque la cétonémie a disparu ; ce relais est délicat : la demi-vie de l’insuline IV est de l’ordre de quelques minutes, le délai de latence de l’insuline ultrarapide de l’ordre de la dizaine de minutes, celui des insulines lentes de plusieurs heures ;
- la recharge volumique par sérum salé isotonique :
- on considère habituellement que 10 % du poids du corps a été perdu, volume qu’il faut remplacer en 24 heures ;
- par exemple, sérum salé 1 litre en 1 heure, suivi de 1 litre en 2 heures puis 1 litre en 4 heures ;
- les apports potassiques, débutés dès que la kaliémie est < 5 mmol/l :
- par exemple 1 g/h entre 5 et 4,5 mEq/l, 2 g/h entre 4 et 4,5 mEq/l et 3 en dessous de 4 mEq/l, mais seulement après avoir vérifié l’absence d’anurie et avoir mesuré la créatininémie ;
- la situation se complique en situation d’insuffisance rénale aiguë ;
- le traitement du facteur déclenchant éventuel. On gardera une vigilance extrême sur l’examen clinique, en sachant rechercher tous les foyers infectieux cachés, y compris pelviens ; la fièvre peut n’apparaître que secondairement lors de la résolution de la cétose.
La perfusion de bicarbonates n’est préconisée que chez des patients épuisés (qui risquent de réduire leur hyperventilation) dont le pH est < 7,0 : on perfuse alors prudemment (compte tenu du risque d’aggravation de l’hypokaliémie) 100 ml de bicarbonate 1,4 %, renouvelable selon l’évolution du pH.
Traitement préventif
Le traitement préventif consiste à établir des règles éducatives :
- rechercher l’acétone systématiquement dans le contexte glycémie élevée-pathologie intercurrente-nausées ;
- il est contre-productif de rechercher l’acétone à chaque fois que la glycémie dépasse une valeur seuil : il ne faut le faire que dans les situations à risque ;
- en présence d’hyperglycémie et de cétose, le patient doit savoir faire des compléments d’insuline rapide afin de prévenir l’évolution vers la cétoacidose.
B Coma hyperosmolaire
Il s’agit de la décompensation classique du sujet âgé diabétique de type 2 insuffisant rénal, ou inaugurale du diabète lorsque la polyurie a été compensée par des boissons sucrées ou insuffisamment compensée (rôle de l’inaccessibilité aux boissons) ; c’est aussi une forme de présentation chez les patients traités par de fortes doses de glucocorticoïdes.
Ce coma est associé à une mortalité de 20 à 40 %, très dépendante de l’état clinique antérieur et de la pathologie causale.
Les signes cliniques sont la déshydratation intense, intra- et extracellulaire, en général avec insuffisance rénale aiguë (c’est en général la réduction de la diurèse, et donc de la glucosurie, par insuffisance rénale aiguë qui explique l’élévation faramineuse de la glycémie) avec des troubles de la vigilance qui sont parfois révélateurs d’un diabète de type 2 méconnu.
C’est une maladie de la soif : soif non ressentie (sujet âgé, démence), non exprimée (sujet isolé, handicap), non étanchée (handicap, démence) ou mal étanchée (boissons sucrées).
1 Diagnostic biologique
Le diagnostic biologique s’établit selon les critères suivants :
- glycémie > 30 mmol/l [6 g/l] ;
- osmolalité > 320 mOsmol/kg H2O ; calculée selon la formule : (Na+ + 13) × 2 + Glycémie, où la concentration en sodium et la glycémie sont en mmol/l ;
- pH > 7,30 (pas toujours observé lorsque l’insuffisance rénale est assez profonde).
2 Étiologie
Les facteurs de risque sont :
- l’âge > 80 ans ;
- l’infection aiguë ;
- les diurétiques ;
- la mauvaise accessibilité aux boissons : maisons de retraite, état de démence, etc. ;
- la corticothérapie ;
- la chaleur (canicule, fièvre, etc., causes de déshydratation).
3 Traitement
Il s’agit d’une prise en charge hospitalière spécialisée :
- le traitement est essentiellement par réhydratation, d’abord du compartiment extracellulaire (NaCl, pour récupérer une diurèse qui permet le retour de la glucosurie, ce qui permet aussi de contrôler la glycémie) suivie de la réhydratation intracellulaire (eau par voie orale autant que possible plutôt que les perfusions hasardeuses de solutés hypotoniques) :
- le débit de perfusion sera adapté non seulement à la déshydratation estimée (souvent plus de 10 % du poids du corps) mais aussi à la fonction cardiaque, en ayant conscience du risque de défaillance cardiaque chez un patient pourtant encore en état de déshydratation (par incompétence myocardique secondaire à l’hyperosmolarité) ;
- en théorie 1 litre de NaCl 0,9 % en 1 heure, puis 1 en 2 heures, puis 1 en 4 heures ;
- l’insulinothérapie intraveineuse continue comme pour une cétoacidose, 0,1 U/kg/h, sans dépasser 7 U/h. Il est cependant essentiel de contrôler la vitesse de diminution de la glycémie et de se fixer un seuil bas supérieur à 2,5 g/l ;
- les apports en potassium suivent les mêmes règles que dans la cétoacidose, avec la même prudence initiale chez des sujets souvent en insuffisance rénale ;
- la surveillance clinique (conscience, pouls, PA, température, diurèse) et biologique (ionogramme sanguin et créatininémie) ;
- il est essentiel de prévenir les complications de décubitus, de traiter un facteur déclenchant, de prévenir les thromboses veineuses, les obstructions bronchiques par un mucus épaissi ;
- il est essentiel d’éviter, par une réhydratation prudente, un passage par une situation d’hypo-osmolarité, associée à un risque de myélinose centropontique.
À distance de cet épisode aigu, il est souvent possible de reprendre un traitement hypoglycémiant oral. Mais la poursuite d’une insulinothérapie simplifiée permet souvent le passage au domicile d’un personnel de santé, et donc une meilleure prévention des récidives.
Dans les situations d’hyperosmolarité chez des sujets jeunes, sans insuffisance rénale, en général dues à une consommation massive de boissons sucrées, l’arrêt de ces apports inadaptés fait l’essentiel du travail, associé à une réhydratation orale ou parentérale et une insulinothérapie.
Les apports en potassium sont essentiels. Chez tout patient dont on ne connaît pas la consommation habituelle d’alcool et a fortiori chez les alcooliques, la prescription de vitamine B1 est essentielle lors de toute initiation d’une insulinothérapie, en prévention de l’encéphalopathie de Gayet-Wernicke.
C Hypoglycémies
Nous invitons à lire le chapitre 11 (cf. Item 240 – Hypoglycémie) pour les éléments physiopathologiques et cliniques.
1 Généralités
L’hypoglycémie est quasi inévitable chez tout diabétique de type 1 « bien équilibré », souvent pluri-hebdomadaire. Cependant, la mise à disposition des nouvelles technologies (pompes/capteurs de glucose) permet de réduire ce risque. Les pancréas artificiels hybrides (pompe partiellement asservie aux données de glucose interstitiel) dont la commercialisation est proche, apportent une réduction supplémentaire du risque hypoglycémique.
Les hypoglycémies ne s’observent que chez les diabétiques traités par l’insuline, les sulfonylurées (sulfamides hypoglycémiants tels que glibenclamide, gliclazide, glimépiride, glipizide, etc.) ou les glinides (répaglinide). Les analogues de l’insuline, rapides (asparte, lispro et glulisine) ou lents (détémir, glargine, degludec), sont associés à un plus faible risque hypoglycémique que les insulines plus anciennes. De plus, l’utilisation de la pompe à insuline réduit le risque d’hypoglycémies sévères comparativement à un traitement par injections multiples.
La metformine, les inhibiteurs des α-glucosidases intestinales (acarbose), les inhibiteurs de la DPP-4 (sitagliptine, vildagliptine, saxagliptine), les agonistes du récepteur du GLP-1 (exénatide, liraglutide, dulaglutide, semaglutide) et les inhibiteurs de SGLT2 ne sont jamais directement la cause d’une hypoglycémie chez le diabétique mais peuvent cependant potentialiser le risque hypoglycémique de l’insuline et des sulfamides/glinides.
Les hypoglycémies sont classiquement plus fréquentes chez les diabétiques proches des objectifs thérapeutiques (HbA1c < 6,5–7 %). Avec les modalités modernes de prise en charge du diabète (nouveaux antidiabétiques oraux dans le diabète de type 2, nouvelles technologies dans le diabète de type 1 : pompes, capteurs), cette association « HbA1c proche des objectifs »/« hypoglycémies plus fréquentes » tend à disparaître.
2 Définitions
L’hypoglycémie chez le sujet diabétique est maintenant consensuellement définie par un taux de glucose < 70 mg/dl [< 3,9 mmol/l]. Un deuxième seuil < 54 mg/dl [< 3 mmol/l] correspond aux hypoglycémies menaçantes : tout patient qui ne ressent ses hypoglycémies qu’en dessous de ce seuil est à risque d’hypoglycémie sévère et doit avoir du glucagon chez lui. L’hypoglycémie sévère est par définition, quel que soit le niveau de glycémie au moment de l’épisode, une hypoglycémie qui nécessite l’intervention d’une tierce personne. Au sein de ces hypoglycémies sévères, on distingue trois niveaux de gravité (hypoglycémie sévère ; hypoglycémie sévère avec troubles de conscience et/ou convulsion ; hypoglycémie sévère nécessitant une hospitalisation).
3 Risques liés aux hypoglycémies
L’hypoglycémie n’est pas mortelle et ne laisse pas de séquelles cérébrales (sauf cas extrêmes et hypoglycémie très profonde et prolongée). De plus, elle ne participe pas aux complications du diabète, ne déclenche pas directement d’accident vasculaire ou cardiaque (sauf exceptionnels troubles du rythme ou de la conduction). Une hypoglycémie ne peut qu’exceptionnellement être retenue comme cause directe de mort subite chez le diabétique. Il faut cependant rappeler que certaines circonstances de survenue d’une hypoglycémie peuvent mettre indirectement en jeu le pronostic vital : hypoglycémie au volant, sur un échafaudage, lors d’une baignade…
Par ailleurs, l’hypoglycémie est un élément du diagnostic de fragilité du sujet qui, en cas d’hypoglycémie grave, a un risque 2 à 3 fois plus fort de décès de toute cause.
La répétition des épisodes d’hypoglycémie abaisse les seuils de déclenchement de la réponse hormonale de contre-régulation, diminue l’intensité, jusqu’à un retard ou même la disparition des signes neurovégétatifs, favorisant ainsi l’apparition brutale de troubles cognitifs profonds, de troubles du comportement, de comas (hypoglycémie sévère).
4 Correction de l’hypoglycémie
- Ingestion de sucre (15 g, soit 3 morceaux), soda ou barre sucrée, uniquement chez des patients conscients. Attention, le resucrage oral doit être proscrit chez tout patient présentant des troubles de conscience, du fait d’un risque de fausse route.
- Chez les patients inconscients, l’injection de glucagon à raison de 1 mg (Glucagen kit®), en IM (intramusculaire) ou SC (sous-cutané), est facilement réalisable par la famille, ainsi qu’à l’hôpital ; geste plus simple chez les patients agités que l’injection intraveineuse directe d’une ou deux ampoules de soluté de glucose à 30 % ; une nouvelle formulation de glucagon administrable par voie nasale a été récemment mise à disposition (non remboursée).
- Chez les patients traités par sulfonylurées (sulfamides hypoglycémiants), l’administration de glucagon est classiquement contre-indiquée. Une perfusion de glucose doit être installée pour une durée supérieure de 2 à 3 fois la demi-vie de la sulfonylurée en cause.
5 Situations favorisantes
Dans tous les cas, il faut rechercher une cause à l’hypoglycémie :
- délai trop long entre l’injection d’insuline (ou la prise de la sulfonylurée) et l’ingestion de glucides (risque majoré par la gastroparésie) ;
- dose d’insuline excessive par rapport à la quantité de glucides réellement consommée ;
- effort physique impromptu, non précédé d’une diminution de dose d’insuline ou d’une collation glucidique ;
- diminution des besoins en insuline lors de la guérison d’événements intercurrents tels que la grippe, une chirurgie, l’arrêt d’un traitement hyperglycémiant (en particulier les glucocorticoïdes), etc. ;
- erreur dans l’injection de l’insuline ou dans la dose de sulfonylurée.
Souvent aucune cause n’est retrouvée : c’est une grande source de perplexité, de frustration et d’angoisse chez le diabétique. Des hypoglycémies répétées et inexpliquées peuvent inciter le patient à relever ses objectifs glycémiques afin de s’éloigner du risque hypoglycémique, quitte à être exposé à une hyperglycémie permanente.
________________________________________________________________________________
Points-clés
- Le facteur étiologique commun à toutes les complications du diabète est l’hyperglycémie chronique.
- Il s’associe à d’autres facteurs modifiables aussi importants, comme l’hypertension artérielle. Le traitement de l’HTA est bénéfique non seulement sur les pathologies cardiovasculaires mais aussi pour le rein et la rétine.
- Il est prouvé que lutter globalement contre ces facteurs est efficace.
- Les pathologies cardiovasculaires sont plus fréquentes chez le diabétique et, quand elles sont patentes, elles sont plus graves : deux tiers des diabétiques en mourront. Mais l’évolution récente dans la prise en charge des patients diabétiques, avec prescription raisonnée et sans retard de statines et de bloquants du système rénine-angiotensine-aldostérone réduit l’excès de mortalité cardiovasculaire chez les diabétiques.
- Les complications ont toutes une longue phase asymptomatique : le dépistage est un impératif.
- L’examen des pieds fait partie de toute consultation chez un patient diabétique.
- Le premier traitement d’une lésion podologique est la décharge, c’est-à-dire l’absence d’appui.
________________________________________________________________________________
© CEEDMM – Septembre 2022.
