
Accédez au site  |
 |
Lettre N°7 - Juin 2014 Avec la participation du Pr Jean-Louis Wémeau (Lille) |
|
• Un nouveau gène muté dans les cancers thyroïdiens agressifs : TERT S. Espiard, M. d’Herbomez (Lille) |
[L'ACTUALITÉ COMMENTÉE] [L'IMAGE COMMENTÉE] |
Technétium : un risque de pénurie inquiétant pour la santé publique
Entre 2016 et 2018, pourrait survenir une pénurie de Technétium 99 métastable (99mTc), principal élément radioactif utilisé en médecine nucléaire pour la réalisation de scintigraphies.
Au niveau mondial, sa production n’est assurée que par 9 réacteurs dont 5, qui représentent 90 à 95 % de la production mondiale, ont plus de 40 ans d’âge et connaissent des arrêts longs et fréquents. L’indisponibilité d’un petit nombre d’entre eux entraîne une pénurie, comme on l’a vu en 2007-2008.
L’autorisation de fonctionnement du réacteur français Osiris, qui couvre 10 à 12 % de la demande mondiale, court jusqu’à fin 2015. Le réacteur Jules Horovitz du Commissariat à l'énergie atomique (CEA), qui doit le remplacer, ne sera opérationnel qu’en 2018-2020 et 2 réacteurs – canadien et belge –, seront indisponibles en 2016. Une période de pénurie est donc certaine de 2016 à 2018 si rien n’est fait pour la prévenir.
Actuellement, près de 75 % des examens scintigraphiques utilisent le 99mTc avec des indications qui recouvrent pratiquement tous les domaines de la médecine, apportant des renseignements fonctionnels et métaboliques qu’aucune autre technique d’imagerie ne peut fournir.
Une pénurie durable de technétium rendrait impossibles 6 indications majeures : la détection du ganglion sentinelle avant chirurgie pour cancer du sein, la recherche d'embolie pulmonaire chez la femme enceinte, la plupart des scintigraphies de l’enfant (principalement osseuses et rénales), l’évaluation de la fonction séparée des deux reins, les contre-indications aux produits de contraste radiologiques, notamment les patients diabétiques atteints d’insuffisance rénale ou traités par la metformine, la détection scintigraphique de l’origine d’une hyperparathyroïdie, complémentaire de l’échographie. Ces examens représentent plusieurs dizaines de milliers d’actes par an en France.
D’autres examens sont en théorie substituables, mais…
- Les quelque 495 000 scintigraphies osseuses annuelles en France, à la base du dépistage des métastases, notamment des cancers mammaires ou prostatiques, pourraient être remplacées par une tomographie à emission de positons (TEP) au fluorure de sodium. Mais ce serait en pratique impossible, pour des raisons de disponibilité de nos 128 TEP et des équipes médicales et paramédicales. De plus, le coût élevé du fluorure de sodium pourrait entraîner un surcoût total de 150 000 000 d'euros par an.
- Les scintigraphies cardiaques qui permettent d’évaluer la perfusion du myocarde pour le diagnostic et la surveillance d’une insuffisance coronaire et qui utilisent des traceurs marqués au 99mTc pourraient être faites en utilisant du Thallium radioactif. Mais le Thallium a un coût plus élevé et il entraîne une dose de rayonnement supplémentaire très significative.
Pour 2 examens, la substitution est possible et présente d’indéniables avantages, conduisant à la recommander, en dehors de toute pénurie de 99mTc :
- Pour les quelques 90 000 scintigraphies thyroïdiennes annuelles, l’iode 123 (123I) est plus cher mais préférable au 99mTc, soit pour la caractérisation des nodules (car 123I explore le captage et l’organification de l’iodure, alors que 99mTc ne renseigne que sur le captage) ; soit, dans un contexte d’hyperthyroïdie, si on envisage un traitement par l’iode radioactif, captage et organification de l’iodure par la thyroïde étant des données nécessaires.
- Les scintigraphies cérébrales pour le diagnostic des troubles cognitifs, peuvent être faites par TEP, avec un résultat plus satisfaisant qu’avec les traceurs marqués au 99mTc, et une économie de produit radioactif. Faire en TEP les quelques 40 000 scintigraphies cérébrales annuelles qui utilisent le 99mTc pose également le problème de la disponibilité des TEP.
Enfin, il faut noter le développement de nouveaux radiopharmaceutiques marqués au 99mTc, adaptés à la médecine personnalisée dans une approche dite “théranostique”, et en cours d’enregistrement (par exemple antigène membranaire spécifique de la prostate).
En conclusion, pour la majorité des examens scintigraphiques utilisant actuellement des traceurs marqués au 99mTc, la substitution en cas de pénurie durable serait impossible, avec des conséquences graves pour les dizaines de milliers de patient(e)s qui ne pourraient pas bénéficier de ces examens.
André Aurengo
Service de médecine nucléaire, hôpital La Pitié-Salpêtrière, Paris

Les anticorps anti-récepteur de la TSH (Thyroid Stimulated Hormone) dosés par des méthodes de 3e génération : des résultats à interpréter avec une extrême prudence dans le suivi des patients
C. Massart (Rennes), M. d’Herbomez (Lille)
Les anticorps anti-récepteur de la TSH (Ac R-TSH) représentent le marqueur de diagnostic et de suivi des patients atteints de maladie de Basedow. Leur dosage a été effectué pendant des années par immuno-analyse à l’aide d’une trousse de 2e génération (2G) utilisant un R-TSH humain et de la TSH radiomarquée de très haute sensibilité et spécificité cliniques dans l’exploration de la maladie de Basedow. De nouveaux dosages de 3e génération (3G) utilisant un anticorps monoclonal (M22) dirigé spécifiquement contre la poche du R-TSH liant l’hormone ont été récemment commercialisés. Ces méthodes ELISA ou par chimiluminescence présentent des performances cliniques similaires à celles du TRAK humain dans le diagnostic de la maladie de Basedow. Par ailleurs, certains avantages liés à la rapidité des systèmes automatisés ou à la facilité d’utilisation par absence d’isotopie ont été publiés. Néanmoins, une haute variabilité inter-techniques de ces dosages 3G (seuils de positivité variant de 0,4 à 1,75 UI/L et pentes des droites de régression fluctuant de 0,8 à 1,4 selon les techniques comparées au TRAK humain) a été démontrée (1). Suite à ces études, le NIBSC (National Institute Biological Standard Calibration) a produit un nouvel étalon sur lequel tous les fournisseurs de méthodes 2G ou 3G devraient à l’avenir se recalibrer pour une harmonisation des résultats (2). Tant que la restandardisation n’a pas été réalisée, la haute variabilité inter-techniques impose un dosage dans le même laboratoire pour le suivi des patients. Cette attitude permettra d’éviter des interprétations erronées des résultats notamment dans le suivi de la grossesse chez les patientes présentant ou ayant présenté une maladie de Basedow.
Références bibliographiques
- Massart C, Sapin R, Gibassier J, Agin A, d’Herbomez M . Intermethod variability in TSH-receptor antibody measurement : implication for the diagnosis of Graves’ disease and for the follow-up of Graves’ ophthalmopathy. Clin Chem 2009;55(1):183-186.
- Massart C, d’Herbomez M . TSH-receptor antibody assays: recommendation for correct interpretation of results in Graves’ disease. Clin Chem 2013;59(5):855.
.................................................................................................................................................................................
Un nouveau gène muté dans les cancers thyroïdiens agressifs : TERT
S. Espiard, M. d’Herbomez (Lille)
Plusieurs marqueurs moléculaires pronostiques ont été caractérisés ces dernières années dans les cancers thyroïdiens, en particulier les mutations de RAS, PIK3CA, PTEN, P53, ALK et BRAF (1).
L’équipe de M. Xing à Baltimore a récemment mis en évidence un nouveau marqueur pronostique du cancer thyroïdien (2). Il s’agit du gène TERT, codant pour la sous-unité catalytique de la télomérase. La télomérase permet le maintien de la longueur des télomères à l’extrémité des chromosomes. Elle joue un rôle clé dans l’immortalité cellulaire et la tumorigénèse. Deux mutations localisées au niveau du promoteur de TERT (C228T et C250T) ont été récemment mises en évidence dans le mélanome (3, 4). Ces mutations conduisent à une augmentation de l’expression du gène en réponse aux facteurs de transcription ETS (5). La mutation C228T a été identifiée dans 11,7 % des carcinomes papillaires de la série (30/257), 11,4 % des carcinomes folliculaires (9/79), 37,5 % des cancers peu différenciés (3/8) et 42,6 % des cancers anaplasiques (23/54) alors qu’elle n’est présente dans aucune des 85 tumeurs thyroïdiennes bénignes analysées. Cette mutation, parmi les carcinomes papillaires, est observée plus fréquemment pour les variants à grandes cellules (30,8 %) que pour les variants conventionnels (12,3 %) ou folliculaires (3,6 %) [2]. La mutation C250T est moins fréquente et mutuellement exclusive de la mutation C228T (2, 6). Une deuxième étude confirme une fréquence plus élevée de ces mutations pour les carcinomes papillaires bien différenciés (22,5 %, 18/80) que pour les cancers peu différenciés et anaplasiques (51 %, 40/78) [6]. Pour ces cancers peu ou indifférenciés, les mutations de TERT sont plus fréquentes en cas de mutations de BRAF ou de RAS qu’en leur absence (67,3 versus 24,1 %) alors que le contraire est observé pour les papillaires bien différenciés (11,8 versus 50 %) [6]. Les mutations du promoteur TERT semblent donc associées aux formes plus agressives de cancer thyroïdien. Le rôle fonctionnel de TERT dans la cancérogénèse thyroïdienne reste à être étudié. Ce gène constitue une nouvelle piste de marqueur diagnostique, pronostique, voire une nouvelle cible thérapeutique.
Références bibliographiques
- Xing M, Haugen BR, Schlumberger M. Progress in molecular-based management of differentiated thyroid cancer. Lancet 23 mars 2013;381(9871):1058-69.
- Liu X, Bishop J, Shan Y et al. Highly prevalent TERT promoter mutations in aggressive thyroid cancers. Endocr Relat Cancer 2013;20(4):603-10.
- Huang FW, Hodis E, Xu MJ, Kryukov GV, Chin L, Garraway LA. Highly recurrent TERT promoter mutations in human melanoma. Science 2013;339(6122):957-9.
- Horn S, Figl A, Rachakonda PS et al. TERT promoter mutations in familial and sporadic melanoma. Science 2013;339(6122):959-61.
- Vinagre J, Almeida A, Pópulo H et al. Frequency of TERT promoter mutations in human cancers. Nat Commun 2013;4:2185.
- Landa I, Ganly I, Chan TA et al. Frequent somatic TERT promoter mutations in thyroid cancer: higher prevalence in advanced forms of the disease. J Clin Endocrinol Metab 2013;98(9):E1562-6.

L’immunohistochimie anti-BRAFV600E dans le cancer de la thyroïde est en faveur de la théorie de survenue clonale de la mutation dans la tumorigenèse
C. Buffet, L. Leenhardt (Paris)
D’après Ronald A. Ghossein, Nora Katabi, and James A. Fagin Immunohistochemical detection of mutated BRAF V600E supports the clonal origin of BRAF-induced thyroid cancers along the spectrum of disease progression. J Clin Endocrinol Metab 2013;98(8):E1414-21
Les mutations activatrices de l’oncogène BRAF, en particulier la mutation BRAFV600E, sont identifiées dans plus de 45 % des carcinomes papillaires de la thyroïde (CPT). Cette mutation est également identifiée dans les cancers peu différenciés et anaplasiques. Les CPT BRAFV600E ont un pronostic plus mauvais que les CPT porteurs d’une autre anomalie génétique. Des thérapies ciblant BRAF ou BRAFV600E ont été testées dans les cancers thyroïdiens évolutifs réfractaires à l’iode porteurs d’une mutation BRAFV600E.
Cette mutation est classiquement identifiée à partir de l’analyse de l’ADN d’une tumeur (en paraffine ou congelée) notamment par séquençage après PCR (Polymerase Chain Reaction). L’identification de la mutation BRAFV600E de cette façon présente plusieurs limites :
- en cas de dégradation de l’ADN, la recherche de la mutation n’est pas possible ;
- absence de possibilité d’identifier le pourcentage de cellules porteuses de la mutation au sein de la tumeur.
La mise au point récente d’un anticorps spécifiquement dirigé contre BRAFV600E utilisé en immunohistochimie (IHC) initialement dans des mélanomes mutés BRAFV600E puis pour des CPT pourrait permettre de pallier à ces limites (1).
La survenue de cette mutation est habituellement considérée comme un évènement de survenue précoce dans la tumorigenèse thyroïdienne car :
- l’expression de BRAFV600E chez des souris transgéniques s’accompagne du développement de cancers papillaires de la thyroïde ;
- elle est identifiée, y compris dans les microcarcinomes papillaires (< 1 cm).
Un article récent d’une équipe italienne (2) a remis en cause la survenue précoce de cette mutation au cours de la tumorigenèse (théorie clonale). Selon cette équipe, il co-existerait fréquemment au sein d’un même cancer des clones de cellules porteuses de la mutation BRAFV600E et des clones de cellules sans mutation BRAF.
R Md. Ghossein et al. ont analysé les performances de l’IHC BRAFV600E pour des cancers papillaires peu différenciés (n = 38) et anaplasiques (n = 22), ce qui n’avait encore jamais été fait ainsi que pour des CPT (n = 31). Ils ont également analysé l’hétérogénéité potentielle des tumeurs, concernant la présence de la mutation BRAFV600E.
Ces auteurs ont montré une excellente sensibilité et spécificité de l’IHC BRAFV600E pour les CPT ainsi que les cancers peu différenciés et anaplasiques.
Ils proposent l’algorithme suivant :
- immunohistochimie BRAFV600E fortement positive (côtée 3 +) : la tumeur peut être considérée comme mutée et le génotypage n’est pas nécessaire (dans leur série la mutation BRAFV600E était présente dans 100 % de ces cas) ;
- immunohistochimie BRAFV600E négative ou très faible (1 +) : la tumeur peut être considérée comme non mutée et le génotypage n’est pas nécessaire (dans leur série la mutation BRAFV600E n’était jamais présente dans ces cas) ;
- immunohistochimie modéremment postive (2 +) : génotypage nécessaire pour déterminer le statut BRAF.
Le marquage intra-tumoral de la mutation BRAFV600E au sein de 31 carcinomes avec une IHC BRAFV600E fortement positive était homogène dans 90 % des cas (n = 28/31), confirmant la théorie consensuelle de survenue clonale de la mutation BRAF lors de la tumorigenèse.
Références bibliographiques
- Koperek O, Kornauth C, Capper D et al. Immunohistochemical detection of the BRAF V600E-mutated protein in papillary thyroid carcinoma. Am J Surg Pathol 2012;36(6):844-50.
- Guerra A, Sapio MR, Marotta V et al. The primary occurrence of BRAF(V600E) is a rare clonal event in papillary thyroid carcinoma. J Clin Endocrinol Metab 2012;97(2):517-24.

Caractéristiques échographiques d’un syndrome de Rosai-Dorfman affectant la thyroïde
F-L. Velayoudom (Pointe-à-Pitre)
Le syndrome de Rosai-Dorfman (RD) est une histiocytose décrite pour la première fois en 1969 par J. Rosai et R. Dorfman. Cette pathologie bénigne affecte tous les âges, mais particulièrement les sujets jeunes (avec une prédominance masculine).
Elle se manifeste par l’apparition d’adénopathies cervicales massives, douloureuses et bilatérales, avec fièvre, amaigrissement et sueurs nocturnes. Elle existe sous une forme ganglionnaire ou sous une forme cutanée. Elle peut être associée à des atteintes extra-ganglionnaires (appareil respiratoire, peau, rein, thyroïde, etc.).
L’équipe rapporte ici le cas d’une patiente présentant tous les symptômes évocateurs d’un syndrome de RD et souligne les critères échographiques de la thyroïde (figure 1) et des adénopathies cervicales (figure 2).
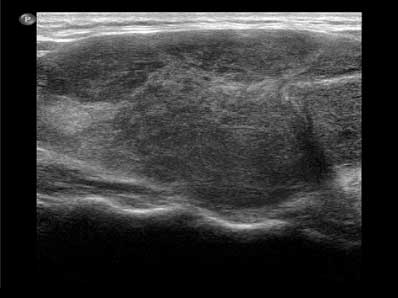 Figure 1. Coupe sagittale du lobe thyroïdien droit : zones hypo-échogènes hétérogènes avec lignes hyper-échogènes intrathyroïdiennes.
Figure 1. Coupe sagittale du lobe thyroïdien droit : zones hypo-échogènes hétérogènes avec lignes hyper-échogènes intrathyroïdiennes.
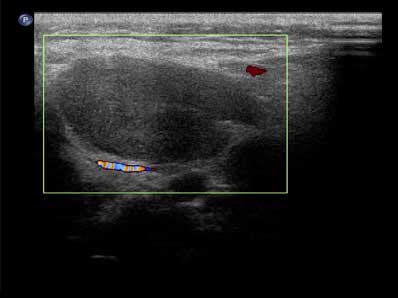 Figure 2. Écho-Doppler : flux détecté au niveau d’une adénopathie cervicale avec un hile peu visible masqué par la présence de tissu adipeux.
Figure 2. Écho-Doppler : flux détecté au niveau d’une adénopathie cervicale avec un hile peu visible masqué par la présence de tissu adipeux.L’aspect échographique apporte une aide majeure au clinicien. Biologiquement, une hyperleucocytose prédominant sur les neutrophiles était notée.
Le diagnostic différentiel est généralement le lymphome malin non hodgkinien.
Le diagnostic définitif est confirmé par l’histologie (figures 3 et 4) et permet la mise en place du traitement qui sera initialement médical et non chirurgical. La corticothérapie est recommandée mais l’utilisation de la cyclophosphamide peut être nécessaire.
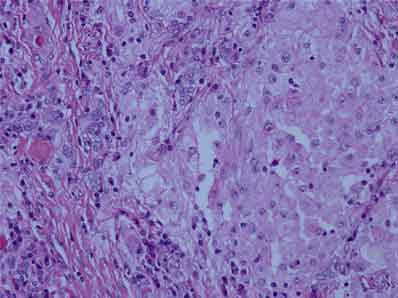 Figure 3. Coupe histologie de la thyroïde : cellules folliculaires remplacées par de larges histiocytes avec un cytoplasme abondant (HE, X 40).
Figure 3. Coupe histologie de la thyroïde : cellules folliculaires remplacées par de larges histiocytes avec un cytoplasme abondant (HE, X 40).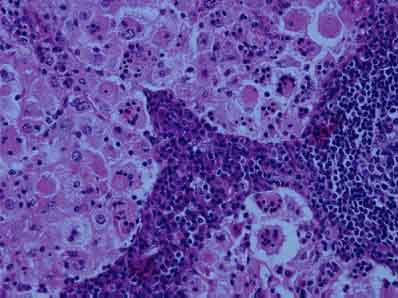 Figure 4. Coupe histologique d’une adénopathie : sinus lymphatiques dilatés avec de nombreux histiocytes à large cytoplasme, témoin de la phagocytose lymphocytaire (HE, hematoxylineosin, grossissement 40X).
Figure 4. Coupe histologique d’une adénopathie : sinus lymphatiques dilatés avec de nombreux histiocytes à large cytoplasme, témoin de la phagocytose lymphocytaire (HE, hematoxylineosin, grossissement 40X).Référence bibliographique
- Wen WL, Parajuly SS, Yan L, Yong J, Di Ming C. Sonographic Manifestation of Thyroid's Rosai-Dorfman Disease. J Med Ultrasound 2012;20(1):54-7.
Vous recevez cette newsletter car vous vous êtes inscrit sur le site de la SFE. Si vous ne voulez plus recevoir cette newsletter, cliquez sur le lien suivant Désinscription. Conformément à la loi Informatique et Libertés du 06/01/1978, vous disposez d'un droit d'accès, de rectification et d'opposition aux informations vous concernant qui peut s'exercer par courrier à : SFE 88, rue de la Roquette - 75011 – Courriel : webmaster@sfendocrino.org
