
Accédez au site  |
Avec le soutien des laboratoires Ultrasonix |
 |
Lettre N°5 - Novembre 2012 |
| SPÉCIAL IMAGERIE | |
[ÉDITO] Quelles indications pour la cytoponction des ganglions lors de la surveillance des cancers thyroïdiens différenciés ? [L'ACTUALITÉ COMMENTÉE] |
[MISES AU POINT] |
Quelles indications pour la cytoponction des ganglions lors de la surveillance des cancers thyroïdiens différenciés ?
Laurence Leenhardt (Paris)
Des recommandations européennes, françaises et américaines ont été publiées pour la prise en charge des cancers thyroïdiens différenciés de souche vésiculaire (1-5). Elles ont permis de proposer une prise en charge rationnelle basée sur le niveau de risque des patients. On distingue les patients à très faible et à faible risque (pT1, T2, N0, Nx), dont le risque de récidive est de 2 à 3 %, les patients à risque intermédiaire présentant une atteinte ganglionnaire N1 quel que soit le pT, dont le risque de récidive est plus élevé (de l’ordre de 18 à 20 %), et enfin les patients à haut risque de récidive locale (pouvant atteindre 60 %) et de métastases à distance. L’échographie cervicale, associée au dosage de thyroglobuline (Tg) sous stimulation, apparaît comme le meilleur examen de détection de ces récidives. L’aspect des ganglions observés lors de l’examen va conditionner l’indication de la cytoponction ganglionnaire. Cette ponction doit systématiquement être associée à un dosage de Tg in situ afin de documenter avec certitude la métastase ganglionnaire. Celle-ci peut correspondre à une simple persistance chez un patient dont le curage a été incomplet ou simplement non réalisé, ou bien à une authentique récidive. Ces adénopathies métastatiques sont le plus souvent homolatérales à la tumeur, préférentiellement dans le secteur VI, et en IIa, III et IV, plus rarement dans le secteur V.
L’étude des 7 critères suivants doit être systématique pour la caractérisation des formations ganglionnaires : taille, forme, échogénicité, hile, microcalcifications, kystisation, distribution de la vascularisation. Les critères les plus spécifiques de l’origine thyroïdienne d’une adénopathie sont la présence de microcalcifications (ou ponctuations hyperéchogènes) et/ou de zones kystiques et/ou une échostructure rappelant le tissu thyroïdien (ganglion hyperéchogène) et/ou une vascularisation périphérique et centrale.
Une adénopathie est considérée comme fortement suspecte si elle présente au moins 1 de ces 4 critères.
En revanche, un ganglion bénin est défini par un hile hyperéchogène et/ou une vascularisation centrale hilaire sans vascularisation périphérique, et par une absence des 4 critères majeurs de suspicion.
La cytoponction utilise des aiguilles fines (25 à 27 G). L’opérateur doit être entraîné. Il faut éviter ce geste en cas de troubles de la crase sanguine. Si la cytoponction est indispensable, un traitement préventif et des précautions sont à prévoir avec l’hématologue. De même, des précautions sont à prendre en cas de traitement par antivitamine K ou par antiagrégant, avec évaluation des risques et des bénéfices.
Un schéma échographique de repérage de la structure à ponctionner à portée de vue, les précautions habituelles d’asepsie seront respectées et de 1 à 3 passages à l’aiguille fine seront réalisés avec étalement, séchage à l’air et coloration de MGG des étalements (ou utilisation de milieux liquides).
Le compte-rendu doit indiquer si le matériel est satisfaisant ou non pour permettre un diagnostic et indiquer le résultat :
- prélèvement non satisfaisant : constitué de globules rouges sans matériel lymphoïde ni cellules épithéliales ;
- adénopathie réactionnelle : présence de lymphocytes, de macrophages à corps tingibles et de plasmocytes sans cellules épithéliales ;
- adénopathie maligne : le plus souvent métastase d’un carcinome thyroïdien de souche vésiculaire, mais métastase ganglionnaire d’un autre type de cancer possible bien que rare. Elle se définit par la présence de cellules épithéliales atypiques.
Les critères échographiques de malignité de ces ganglions sont donc à bien connaître afin de sélectionner les indications de cytoponction.
Les adénopathies qui présentent au moins 1 des caractéristiques suivantes doivent impérativement être ponctionnées :
• des microcalcifications ;
• et/ou une ou des zone(s) kystique(s) ;
• et/ou une vascularisation périphérique et/ou mixte périphérique et interne anarchique (sauf contexte infectieux évident) ;
• et/ou un ganglion hyperéchogène rappelant le tissu thyroïdien.
Les 3 critères échodoppler suivants sont individuellement peu discriminants, mais leur association doit faire considérer une cytoponction avec dosage in situ de Tg selon le contexte (niveau de risque, taux de Tg) :
• petit axe ≥ 8 mm ;
• et rapport L/S < 2 ;
• et absence de hile.
Les critères suivants sont très fortement évocateurs de bénignité et ne doivent pas conduire à la réalisation d’une cytoponction :
• absence des 4 critères majeurs de suspicion ;
• et hile hyperéchogène et/ou vascularisation centrale hilaire sans vascularisation périphérique et/ou chirurgie non envisageable.
Le prélèvement pour dosage de Tg intraganglionnaire se fait par le rinçage de chaque aiguille de ponction dans un volume de 1 ml (en cas de passages multiples pour un même ganglion, les différentes rinçures d’aiguilles peuvent être recueillies dans un même tube) :
• soit avec du sérum salé physiologique (0,9 % NaCl) ;
• soit avec le tampon du dosage ou un pool de sérum “Tg free” fourni par le laboratoire qui effectue le dosage.
Le dosage de Tg in situ est réalisé à l’aide d’une méthode de dosage de type immunométrique, calibrée sur le standard CRM 457 (sensibilité fonctionnelle entre 0,1 et 1,0 µg/l) [4]. Les résultats en ng/cytoponction expriment la quantité de Tg présente dans le liquide de rinçage de l’aiguille utilisée pour la ponction (1 ml par aiguille rincée). Il n’y a pas de corrélation entre le taux de Tg sérique et le taux de Tg dans le ganglion. Il n’y a pas de contamination significative par la Tg sérique ni d’interférence due aux auto-anticorps anti-Tg (Ac anti-Tg) dans le dosage sur le liquide de rinçage. Il n’est donc pas nécessaire de doser les Ac anti-Tg dans le liquide de rinçage.
Il est recommandé d’associer à toute ponction de ganglion suspect de métastase d’un cancer de la thyroïde un dosage de Tg sur liquide de rinçage d’aiguilles (4). Si plusieurs adénopathies sont suspectées dans un même territoire, la ponction d’une seule suffit.
L’intérêt majeur du dosage de Tg in situ réside dans le cas des ganglions kystiques, lorsque la cytoponction est “paucicellulaire” : la cytologie étant alors prise en défaut, le dosage de Tg in situ se révèle très informatif.
Dans le cas de cancers peu différenciés, les valeurs de Tg in situ sont en général plus basses (ou négatives selon les équipes), constituant alors des “faux négatifs”.
Associer le dosage de Tg in situ à la cytologie améliore la sensibilité de 91 à 100 %. La spécificité est de 96,2 % et la valeur prédictive positive de 97,2 % au seuil de 1 µg/l.
Le seuil de décision appliqué est variable selon les études. Il doit être relié à la sensibilité fonctionnelle du dosage. Le consensus recommande (5) :
• Tg < 1 ng/cytoponction : résultat normal ;
• Tg entre 1 et 10 ng/cytoponction : à confronter aux résultats de la cytologie (peu de données dans la littérature) ;
• Tg > 10 ng/cytoponction : en faveur de la présence de tissu tumoral.
Le problème des petites images ganglionnaires : si on reconnaît à l’échographie une sensibilité diagnostique correcte, on lui reproche souvent ses faux positifs qui font courir le risque de ponctionner de façon inutile des ganglions bénins, ce qui représente une source d’anxiété pour le patient. On a rapporté jusqu’à 38 % de faux positifs dans la série de Castagna (6). L'interprétation des différents critères échographiques de suspicion de malignité des ganglions est d'autant plus difficile que les ganglions décrits sont de petite taille. Les ganglions normaux mesurant moins de 8 mm sont très souvent arrondis et sans hile hyperechogène. Les experts s’accordent pour dire (5) :
• qu’il est déconseillé de ponctionner sytématiquement des ganglions dont le petit diamètre est inférieur à 5-7 mm ;
• qu’il est licite de les ponctionner si le taux de Tg sérique est anormal et s'ils s’accompagnent d’au moins 2 critères échographiques de suspicion de malignité.
S’ils ne sont pas ponctionnés, une échographie de contrôle est préconisée pour s'assurer qu'ils ne progressent pas et qu'aucun critère échographique de suspicion de malignité n'apparaît. Plusieurs publications récentes insistent sur la faible évolutivité de ces images lorsqu’elles sont simplement surveillées (7). Le délai de l'échographie de contrôle est de 6 à 12 mois, à adapter au risque de récidive (pTNM initial et réévaluation du risque au bilan 6 à 12 mois après le traitement initial) et aux autres critères que sont le nombre de ganglions initiaux envahis, l’existence de ruptures capsulaires et le taux de Tg sérique.
En conclusion, les indications de la cytoponction ganglionnaire doivent se fonder sur un examen échographique de qualité. La constatation de petites images ganglionnaires non univoques ne représente jamais une urgence diagnostique et doit plutôt inciter à une attitude initiale de surveillance.
Références bibliographiques
1. Cooper DS, Doherty GM, Haugen BR et al. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2006;16:109-42.
2. Pacini F, Schlumberger M, Dralle H et al. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006;154:787-803.
3. Cooper DS, Doherty GM, Haugen BR et al . Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;19:1167-214.
4. Borson-Chasot F, Bardet S, Bournaud C et al. Guidelines for the management of differentiated thyroid carcinomas of vesicular origin. Ann Endocrinol (Paris) 2008;69:472-86.
5. Leenhardt L, Borson-Chazot F, Calzada M et al. Good practice guide for cervical ultrasound scan and echo-guided techniques in treating differentiated thyroid cancer of vesicular origin. Ann Endocrinol (Paris) 2011;72:173-97.
6. Castagna MG, Brilli L, Pilli T et al. Limited value of repeat recombinant human thyrotropin (rhTSH)-stimulated thyroglobulin testing in differentiated thyroid carcinoma patients with previous negative rhTSH-stimulated thyroglobulin and undetectable basal serum thyroglobulin levels. J Clin Endocrinol Metab 2008;93:76-81.
7. Robenshtok E, Fish S, Bach A, Domínguez JM, Shaha A, and Tuttle RM. Suspicious Cervical Lymph Nodes Detected after Thyroidectomy for Papillary Thyroid Cancer Usually Remain Stable Over Years in Properly Selected Patients. J Clin Endocrinol Metab 2012;97:2706-13.

Le laser : un traitement des thyroïdites lymphocytaires chroniques
Jean-Louis Wémeau (Lille)
Höfling DB, Chavantes MC, Juliano AG et al. Low-level laser in the treatment of patients with hypothyroidism induced by chronic autoimmune thyroiditis: a randomized, placebo-controlled clinical trial. Lasers Med Sci 2012 Jun 21. [Epub ahead of print]
Nombre de facteurs génétiques et liés à l’environnement interviennent dans la constitution des thyroïdites lymphocytaires chroniques (TLC), expression la plus évidente de l’auto-immunité antithyroïdienne. Cela explique qu’une approche pathogénique soit guère envisageable. La corticothérapie ou les médications immunosuppressives sont efficaces, mais leur effet est transitoire, et en traitement prolongé, elles s’avèrent plus délétères que la TLC elle-même. De ce fait, la majorité des TLC est simplement surveillée (thyroïdites auto-immunes symptomatiques) ou soumise à l’hormonothérapie thyroïdienne donnée à visée substitutive ou frénatrice du volume thyroïdien ; la lévothyroxine est aussi susceptible de réduire les titres d’anticorps antithyroïdiens, ce que la diminution de l’exposition des antigènes thyroïdiens expliquerait, mais cet effet n’est apparent que si la TSH est accrue.
C’est pourquoi on voit apparaître avec intérêt une approche thérapeutique innovante, par un procédé physique utilisant le laser. Dans une étude prospective versus placebo, 43 patients atteints de TLC et soumis à la lévothyroxine ont été reçus soit pour 10 séances de LLLT (low level laser therapy), soit pour 10 séances de placebo. La lévothyroxine a été interrompue 30 jours après la période de laser ou de placebo. On a procédé à une évaluation des titres d’anticorps, de l’échogénicité quantitative, des doses requises pour obtenir l’euthyroïdie après 9 mois.
L’enquête a révélé une réduction des doses de lévothyroxine et des titres d’anticorps anti-TPO : 39 + 20 versus 106 + 23 µg/j (p = 0,043). Enfin l’hypoéchogénicité, expression du processus de TLC, s’est très nettement atténuée avec une augmentation très significative de l’échogénicité quantitative (p < 0, 001).
Cette approche très séduisante, susceptible d’enrayer un processus affectant 10 à 20 % de la population féminine adulte et 3 à 5 % des hommes, mérite d’être confirmée. Il faudra aussi évaluer son bénéfice réel à long terme, ainsi que sa complète innocuité.

Stratification du risque en échographie des nodules thyroïdiens
Gilles Russ (Paris)
À partir de 2007, le concept de stratification du risque en échographie thyroïdienne relie les aspects observés à un risque de malignité, permettant de rationaliser la conduite à tenir dans la prise en charge des nodules thyroïdiens.
En 2007, 2 équipes, 1 coréenne (1) et 1 japonaise (2), introduisent la notion de “grading” en échographie thyroïdienne : il s’agit d’une stratification qualitative des aspects des nodules en classes et sous-classes visant à définir les nodules qui justifient un prélèvement cytologique ou une chirurgie. Cette approche ouvre la porte aux systèmes publiés à partir de 2009 et dont le nom générique est TI-RADS (Thyroid-Imaging Reporting and Data System). Cette fois, les aspects échographiques sont reliés à un risque quantitatif de malignité. Quatre publications (3-6) rapportent ces travaux.
Il faut retenir que l’on peut dissocier :
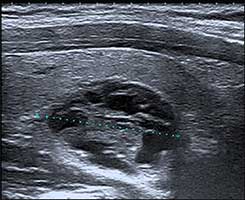
• des nodules constamment ou très probablement bénins dont le score TI-RADS est 2 ou 3 et dont le risque de malignité est strictement inférieur à 4 % (1/400 dans notre série prospective). En échographie, ces nodules n’ont aucun signe de forte suspicion et sont isoéchogènes ou hyperéchogènes (figure 1) ;
• des nodules de faible degré de suspicion : TI-RADS 4A. Le risque varie entre 5 et 44 % selon les séries, il est de 6 % en moyenne dans l’étude prospective la plus récente (7). Ces nodules n’ont aucun signe de forte suspicion et sont modérément hypoéchogènes ;
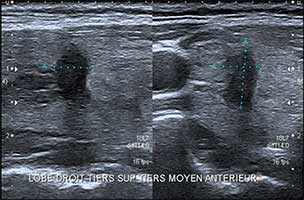
• des nodules fortement suspects dont le score TI-RADS atteint 4 ou 5 et dont le risque de malignité est compris entre 45 et 100 %. Ces nodules présentent au moins 1 des 5 signes suivants, le risque augmentant avec le nombre : forme irrégulière, contours irréguliers, hypoéchogénicité marquée, microcalcifications, rigidité anormale en élastographie (figure 2).
 |
 |
|
Figure 1. Nodule de forme ovalaire, aux contours réguliers, mixte, isoéchogène, en partie spongiforme : score TI-RADS 3. |
Figure 2. Coupes longitudinale et transversale d'un nodule solide et hypoéchogène dont la forme est irrégulière : plus épais que long et plus épais que large. Les contours sont irréguliers, lobulés, voire anguleux. Score TI-RADS 4B. |
Des recommandations concernant les indications des cytoponctions en découlent, qui doivent naturellement être adaptées au cas par cas en fonction du contexte clinique et des antécédents personnels et familiaux :
• scores TI-RADS 2 et 3 : ponction si la taille dépasse 20 mm ou s'il existe un accroissement prouvé ;
• score 4A : ponction si la taille est supérieure à 10 mm ;
• scores 4B et 5 : ponction si la taille est supérieure à 7 mm, voire inférieure si juxta-apsulaire.
Les travaux en cours concernent la possibilité de mieux stratifier les nodules scorés 4A et les cytologies indéterminées, en particulier les néoplasmes folliculaires.
En conclusion, quels que soient le nom et le nombre de classes que prendra le système dans l’avenir, la notion de stratification du risque en échographie des nodules thyroïdiens paraît aussi incontournable qu’elle l’est devenue en cytologie avec la classification de Bethesda.
Références bibliographiques
1. Tae HJ, Lim DJ, Baek KH et al. Diagnostic value of ultrasonography to distinguish between benign and malignant lesions in the management of thyroid nodules. Thyroid 2007;17:461-6.
2. Ito Y, Amino N, Yokozawa T et al. Ultrasonographic evaluation of thyroid nodules in 900 patients: comparison among ultrasonographic, cytological and histological findings. Thyroid 2007;17:1269-76.
3. Horvath E, Majilis S, Rossi R et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab 2009;90:1748-51.
4. Park JY, Lee HJ, Jang HW et al. A proposal for a thyroid imaging reporting and data system for ultrasound features of thyroid carcinoma. Thyroid 2009;19:1257-64.
4. Kwak JY, Han KH, Yoon JH et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk. Radiology 2011;260:892-9.
5. Russ G, Bigorgne C, Royer B, Rouxel A, Bienvenu-Perrard M. Le système TIRADS en échographie thyroïdienne. J Radiol 2011;92:701-13.
6. Russ G, Rouxel A, Bienvenu-Perrard M, Bigorgne C, Royer B. TI-RADS score with and without elastography: prospective evaluation with and without elastography on 4182 nodules. ATA 2012, communication orale n° 20. Thyroid 2012;22 (Suppl 1):A-46.
.................................................................................................................................................................................
Le marquage au charbon colloïdal échoguidé des adénopathies cervicales des cancers thyroïdiens différenciés
Jean Tramalloni (Neuilly)
Les progrès de l’échographie cervicale permettent la mise en évidence d’adénopathies cervicales de petite taille, difficiles à retrouver en peropératoire. Le diagnostic d’adénopathie métastatique est porté avec une grande efficacité par le couple cytoponction échoguidée + dosage de la thyroglobuline sur le liquide de rinçage de l’aiguille de ponction. Bien que l’utilité de l’exérèse chirurgicale de ces petites lésions soit discutée, celle-ci est souvent proposée devant l’absence de fixation du radio-iode par certaines lésions. Une solution radicale est d’ailleurs souvent souhaitée par les patients eux-mêmes.
Dans ces cas, la réintervention chirurgicale est rendue plus difficile par la fibrose postopératoire de l’intervention initiale, notamment dans le compartiment central (4). Dans les compartiments latéraux, malgré la généralisation du schéma de repérage au cours des échographies de surveillance, le ganglion pathologique est parfois laissé en place, car le chirurgien, même expérimenté, ne l’a pas trouvé.
La technique de marquage au charbon colloïdal, initialement développée pour le cancer du sein (6), a donc été logiquement proposée pour ces patients (2).
Il est nécessaire de disposer d’une échographie ganglionnaire de qualité, réalisée selon les recommandations publiées en 2007 par la Société française d’endocrinologie (1, 5). Le ganglion métastatique doit être repéré avec certitude (figure 1).
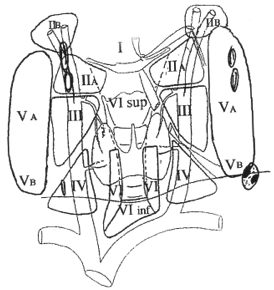
Figure 1. Schéma de repérage ganglionnaire : adénopathie kystique du secteur VB.
La procédure est réalisée comme pour une cytoponction diagnostique, avec un respect scrupuleux des règles d’asepsie. On prépare une seringue de 5 ml dans laquelle la suspension de charbon colloïdal est introduite (Dermopigment, flacon de 3 ml, société Derm Tech France, BP 25, 92132 Issy-les-Moulineaux cedex, France). On utilise des aiguilles de 25 G, un peu plus grosses que celles dont on se sert habituellement pour la cytoponction diagnostique (27 G). En effet, la relative viscosité de la solution rendrait l’injection difficile avec des aiguilles trop fines. Le trajet de ponction doit être aussi direct que possible. Nous évitons d’injecter à l’intérieur du ganglion pour pallier tout risque de rupture du ganglion et pour ne pas gêner la lecture histologique. Le volume injecté est d’environ 1 ml. L’injection du produit est visible à l’échographie. Une certaine pression est maintenue pendant le retrait de l’aiguille afin de tracer le trajet de l’aiguille, si possible jusqu’aux plans superficiels. L’orifice de ponction cutané est parfois marqué, ressemblant à un petit nævus qui s’effacera en quelques semaines (3, 7). Un pansement modérément compressif est appliqué sur le cou, comme après une cytoponction diagnostique. L’injection est rarement douloureuse, mais si c'est le cas, un antalgique simple (paracétamol) est prescrit.
Le marquage au charbon peut être réalisé plusieurs jours avant l’intervention, car il persiste jusqu’à 3 mois (6) [figure 2].Le taux d’échec du marquage est inférieur à 5 % dans les séries publiées.
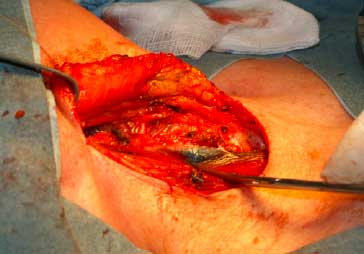
Figure 2. Vue opératoire du ganglion marqué au charbon colloïdal (au-dessus de l’extrémité du ciseau de dissection). Cliché du Dr François Veber.
Références bibliographiques
1. Borson-Chazot F et al.Conférence de consensus : prise en charge des cancers thyroïdiens différenciés de souche vésiculaire. Ann Endocrinol 2007;68 (Suppl S2):53-6 .
2. Hartl DM, Chami L, Al Ghuzlan A et al. Charcoal suspension tattoo localization for differentiated thyroid cancer recurrence. Ann Surg Oncol 2009;16:2602-8.
3. Kang TW, Shin JH, Han BK et al. Preoperative ultrasound- guided tattooing localization of recurrences after thyroidectomy: safety and effectiveness. Ann Surg Oncol 2009;16:1655-9.
4. Kim MK, Mandel SH, Baloch Z et al. Morbidity following central compartment reoperation for recurrent or persistent thyroid cancer. Arch Otolaryngol Head Neck Surg 2004;130:1214-6.
5. Leenhardt L, Borson-Chazot F, Calzada M et al. Guide de bonnes pratiques pour l'usage de l'échographie cervicale et des techniques échoguidées dans la prise en charge des cancers thyroïdiens différenciés de souche vésiculaire. Ann Endocrinol (Paris) 2011;72 (4 Suppl 1): HS1-26.
6. Mathieu MC, Bonhomme-Faivre L, Rouzier R et al. Tattooing breast cancers treated with neoadjuvant chemotherapy. Ann Surg Oncol 2007;14:2233-8.
7. Soprani F, Bondi F, Puccetti M, Armaroli V. Charcoal tattoo localization for differentiated thyroid cancer recurrence in the central compartment of the neck. Acta Otorhinolaryngol Ital 2012;32:87-92.
.................................................................................................................................................................................
Élastographie quantifiée
Hervé Monpeyssen (Neuilly)
Après la vague d’euphorie générée par la nouveauté de la technique et les espoirs s’y rapportant, l’élastographie thyroïdienne est entrée dans une phase mature où l’esprit critique contrebalance l’enthousiasme.
Toutes les études (près de 20) menées entre les années 2005 et 2010 ont utilisé la technique de déformation par compression (Strain Elastography [élastographie relative]) avec une appréciation visuelle de l’encodage couleur (figure 1).
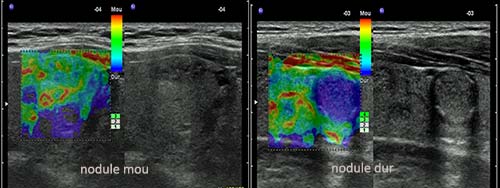
Figure 1. Élastographie relative : appréciation visuelle de la Map-Color.
On utilise le module de Young. Une méta-analyse de 2010 dans la revue Thyroid (1) a montré que les études les plus probantes, car fondées sur l’histologie, donnaient de bon résultats en spécificité et en sensibilité. Certaines imprécisions demeurent, relatives aux critères de compression et d’appréciation des couleurs, et à la grande variabilité interopérateurs. La quantification permet de s’affranchir de certaines de ces imprécisions. Mais que signifie le terme “quantification” en élastographie ? Quatre techniques sont actuellement disponibles sur les différentes machines qui vous sont proposées :
• la quantification de la Map-Color (Esaote) [figure 2].
Elle permet de se soustraire à l’appréciation de notre œil et donne un ratio de rigidité fondé sur la différence de couleur entre 2 ROI (Region Of Interest). Mais à ce jour, le facteur de conversion entre ce ratio et celui observé dans les autres quantifications reste à établir ;
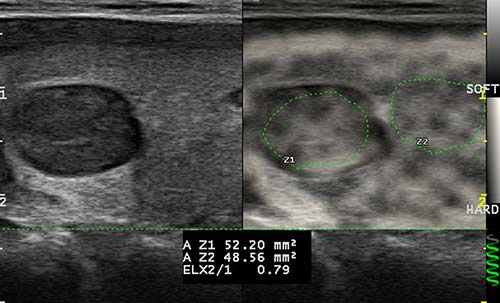
Figure 2. Quantification de la Map-Color.
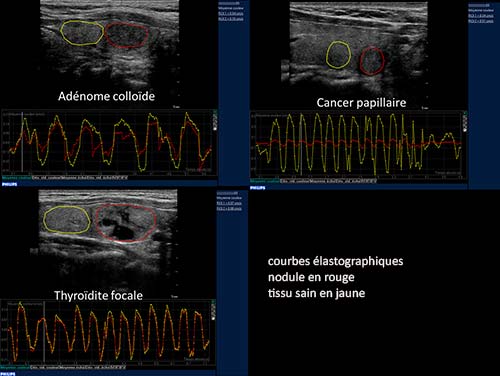
Figure 3. Élastographie relative quantifiée : nodule bénin, cancer papillaire et foyer de thyroïdite.
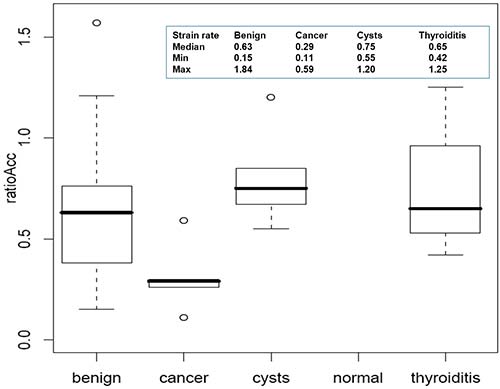
Figure 4. Élastographie relative quantifiée : indices de rigidité en fonction de la nature du nodule.
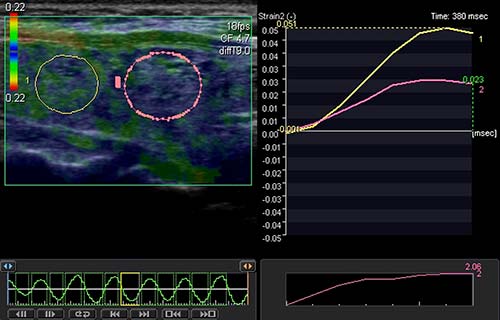
Figure 5. Élastographie relative quantifiée : autre présentation.
• la quantification par étude de l’onde de cisaillement (ShearWave Elastography). On n’apprécie plus la déformation des tissus, mais la variation de la vitesse d’une onde de cisaillement qui les traverse (3). Plus un nodule est dur, plus la vitesse croît. Une formule simple permet de passer du module de cisaillement au module de Young. Deux systèmes sont disponibles, avec des contributions variables :
•• Aixplorer (SuperSonic Imaging), qui, grâce à l’utilisation d’un formateur de faisceau à très haute cadence, donne un résultat en kilopascal et, accessoirement, un ratio de rigidité. C’est la quantification la plus achevée à ce jour et la plus opérateur-indépendant. Plusieurs études ont été publiées (4, 5) [figures 6, 7],
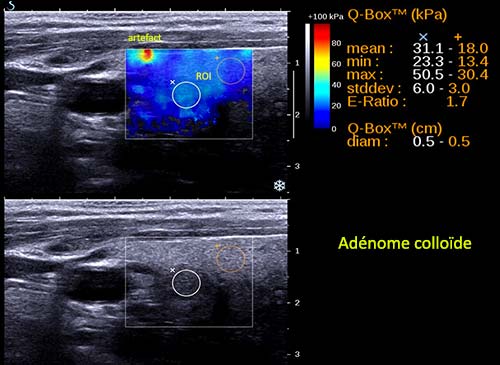
Figure 6. Ondes de cisaillement – Aixplorer : adénome colloïde. Indice de rigidité faible.
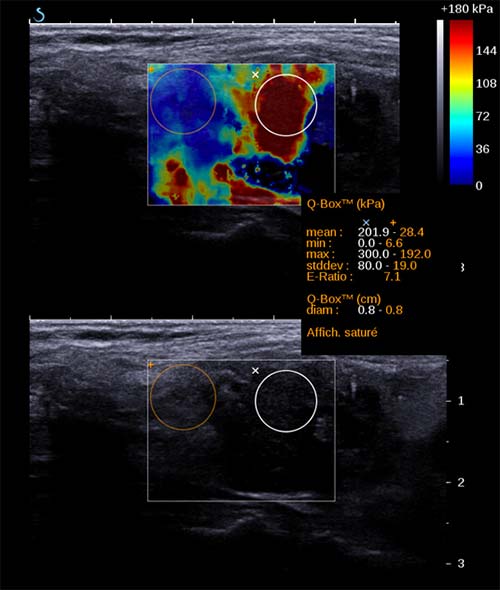
Figure 7. Ondes de cisaillement – Aixplorer : cancer papillaire. Indice de rigidité élevé.
•• ARFI (Siemens), qui ne dispose pas de ce formateur de faisceau et qui analyse les vitesses par insonations itératives. Un facteur de conversion permet de donner un niveau de valeur de rigidité (6) [figure 8] ;
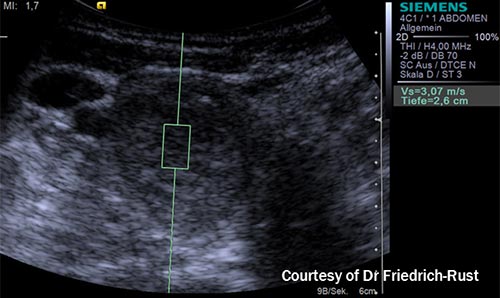
Figure 8. Système ARFI (Acoustic Radiation Force Impulsed-Imaging) [Collection Dr Friedrich-Rust].
• le ShearWave de Philips utilise la technique du fibroscan et n’est donc pas applicable à la thyroïde.
Pour que l’élastographie garde une haute contributivité dans la prise en charge des nodules thyroïdiens, elle doit fournir des indices précis de dureté, disponibles grâce à la quantification. Mais lors du choix que vous serez amenés à faire, face à des constructeurs vous proposant tous une quantification, vous devez savoir de laquelle il s’agit.
Références bibliographiques
1. Bojunga J, Herrmann E, Meyer G, Weber S, Zeuzem S, Friedrich-Rust M. Real-time elastography for the differentiation of benign and malignant thyroid nodules: a meta-analysis. Thyroid 2010;20:1145-50.
2. Monpeyssen H, Correas JM, Tramalloni J, Gauthier T, Helenon O, editors. Quantitative Elastography of Thyroid Nodules: preliminary Results. RSNA SSK13-01; 2008 Chicago.
3. Monpeyssen H, Correas JM, Tramalloni J, Poirée S, Hélénon O. Elastographie thyroïdienne. La Lettre du Cancérologue 2011;5:318-26. Correspondances en Métabolismes Hormones Diabètes et Nutrition 2010;7:202-8.
4. Sebag F, Vaillant-Lombard J, Berbis J et al. Shear wave elastography: a new ultrasound imaging mode for the differential diagnosis of benign and malignant thyroid nodules. J Clin Endocrinol Metab 2010;95:5281-8.
5. Veyrières JB, Albarel F, Lombard JV et al. A threshold value in Shear Wave elastography to rule out malignant thyroid nodules: A reality? Eur J Radiol 2012;doi: 10.1016/j.ejrad.2012.09.002.
6. Friedrich-Rust M, Romenski O, Meyer G et al. Acoustic Radiation Force Impulse-Imaging for the evaluation of the thyroid gland: a limited patient feasibility study. Ultrasonics 2012;52:69-74.
